
随着现代药物递送技术的不断发展,复杂注射剂(特殊注射制剂)因其独特的药物递送优势,成为医药研发领域的热点。其中,脂质体作为一种重要的复杂注射剂,以其独特的结构和功能,在药物递送中展现出巨大潜力。
本文基于药融咨询《基于剂型改良的复杂注射剂分析——脂质体篇》报告内容,旨在全面分析脂质体的定义、分类、临床应用、优缺点以及在中国市场的监管现状,以期为企业/机构相关研究和应用提供参考。
一、复杂(特殊)注射制剂的定义及分类
注射为临床常用的给药方式之一,相关药物递送平台(特殊注射剂)的开发也是近年来的热点。目前特殊注射剂无官方明确定义,通常认为特殊注射剂包括脂质体、微球、胶束、微晶、原位凝胶等,其活性成分在体内行为受制剂技术的影响较大,能够实现如高靶向性、高载荷、低毒副作用等效果。

脂质体(Liposome):纳米颗粒的一种亚型,由疏水尾部和亲水头部构成磷脂膜。
微球(Microspheres):蛋白质或合成聚合物组成,在性质上是可生物降解的,理想的粒度在1-1000μm。
胶束(Micelles):由两亲性聚合物自聚集形成的。
微晶(Nanocrystals):改变晶体大小,从而改变药物体内行为。
原位凝胶(Insitugel):进入人体之前以溶液形式存在的制剂,但在各种生理条件下会转变为凝胶形式。
二、脂质体的定义及分类
脂质体,这一由英国血液学家Alec D. Bangham于1961年描述的结构,自20世纪90年代初期起作为药物载体进入实际应用。从结构上看,脂质体是由膜状脂质双分子层包围着水体积的同心漂流囊泡。双层脂膜通常由磷脂组成,磷脂含有疏水的尾部和亲水的头部。通过调整加入脂质种类可以调整脂质体的性能。脂质体可装载亲水性药物于内部水环境中,也可将疏水性药物嵌入脂质膜之间或吸附在脂质体表面。
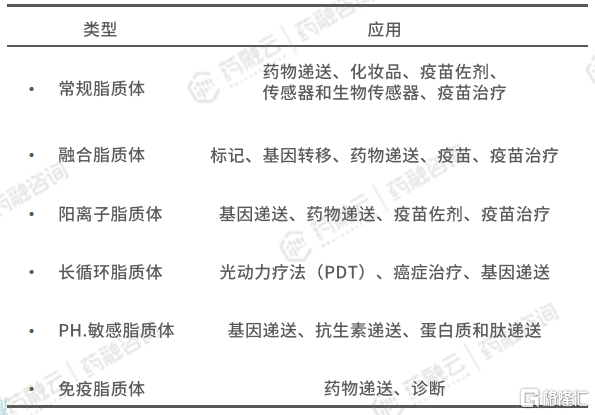
脂质体分类标准众多,包括结构特征、结构参数和尺寸、合成方法、组成成分和载药量等。根据组成成分对脂质体进行分类,可以分为常规脂质体、融合脂质体、阳离子脂质体、长循环脂质体、PH.敏感脂质体、免疫脂质体。

按结构分,可以将脂质体分为单室脂质体、多室脂质体和多囊脂质体。根据脂质体粒径的大小和脂质双层膜数量,可以将脂质体分为:单层脂质体(ULVs)、寡层脂质体(OLVs)、多层脂质体(MLVs)、多囊脂质体(MVLs)。
三、脂质体作为药物递送载体的临床应用
脂质体作为基于胆固醇和天然无毒磷脂的球形囊泡,因其生物相容性、适当的尺寸以及其具有可载药的疏水层和亲水层等特性,目前已被认为是高度通用的纳米颗粒,可用于生物医学中多个领域,特别是对于药物递送。
脂质体在生物医学应用中的应用
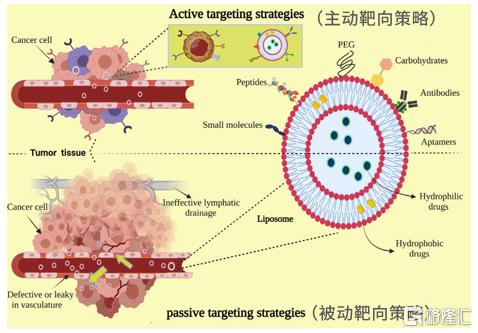
递送抗肿瘤药物是脂质体最被人熟知的运用之一。通过主动靶向策略(基于肿瘤组织生理特点)和被动靶向策略(基于脂质体膜表面修饰),脂质体可将药物靶向递送至肿瘤组织中。
四、脂质体作为药物递送载体的优缺点
1. 脂质体的优势:
基于脂质体特殊的结构,其有许多有独特的优势。(1)可装载水溶性和脂溶性药物,脂质体作为两亲性和非离子结构颗粒,为递送水溶性和脂溶性药物提供了绝佳的机会。(2)结构框架可调节,通过调整脂质体所含脂质可控制脂质体的渗透性、刚性、尺寸。(3)膜表面可修饰,通过将抗体等分子修饰在脂质体表面,可提高靶向、长循环等性能。
2. 脂质体的劣势:
脂质体的结构仍存在一些限制,阻碍了其广泛的临床应用。最重要的障碍归因于它们的物理和化学稳定性。(1)水溶液中溶解性低;(2)部分脂质体体内环境半衰期短;(3)生产成本高;(4)脂质体体积较大增加靶向难度;(5)装载药物的渗漏和融合;(6)磷脂氧化和水解;(7)快速被RES系统识别;(8)某些过敏反应。
五、中国对脂质体的监管现状——非临床药代动力学研究指导原则
脂质体药物非临床药代动力学研究的一般原则可参照已发布的相关技术指导原则,如ICHS3A、S3B、M3(R2)等。具有纳米药物属性的脂质体药物的非临床药代动力学研究可参照《纳米药物非临床药代动力学研究技术指导原则(试行)》。
《脂质体药物非临床药代动力学研究指导原则》

2023年10月,药品审批中心发布了《脂质体药物非临床药代动力学研究指导原则》,对脂质体药物需要特殊关注的内容提出要求。主要适用于化学药物脂质体产品的非临床药代动力学研究,包括创新药、改良型新药和仿制药。单抗、多肽或小分子等配体修饰形成的主动靶向脂质体药物以及环境响应类脂质体药物情况复杂,指导原则中不包括此类脂质体药物的非临床药代动力学研究具体要求,但整体思路和部分共性的非临床药代动力学研究可借鉴该指导原则,并根据品种具体特点进行相应的非临床药代动力学研究。
整体考虑
在开展脂质体药物的非临床药代动力学研究时,应注意比较其与对应的普通药物制剂在药代动力学特征上的异同。一般而言,脂质体药物的药代动力学特征可能取决于:
(1)包封活性成分的脂质体药物自身的清除
(2)包封的活性成分自脂质体中的释放速率
(3)未包封活性成分的清除和代谢
(4)脂质体药物的分布(器官和/或组织分布的变化以及分布的活性成分的量)
(5)脂质体或活性成分与血浆或血清蛋白、血细胞或血管内皮的相互作用等
六、中国对脂质体的监管现状——质量控制研究技术指导原则
脂质体药物质量控制研究中涉及的一般性要求可参照已发布的相关技术指导原则。具有纳米药物属性的脂质体药物的质量控制研究可参照《纳米药物质量控制研究技术指导原则(试行)》。
2023年10月,药品审批中心发布了《脂质体药物质量控制研究技术指导原则》。指导原则主要适用于化学药物脂质体产品的质量研究和质量控制,包括创新药、改良型新药和仿制药。
《脂质体药物质量控制研究技术指导原则》

另外,部分脂质体仿制药可参考个药指南(如适用)。该指导原则暂不包括单抗、多肽或小分子等配体修饰形成的主动靶向脂质体药物以及环境响应类脂质体药物,但整体思路和部分共性的质量研究可借鉴该指导原则。
整体思路
脂质体药物质量控制的整体思路是基于药物评价的风险评估策略和从研发、生产到使用的全过程质量控制策略。基于风险评估的质量控制研究应关注脂质体药物的质量特性对药物的安全性和有效性的影响,重点包括以下几方面:
(1)脂质体药物的类型、剂型、给药途径、临床应用方式和治疗目的等;
(2)脂质体药物的组成、结构形态和完整性;
(3)脂质体药物的粒径及其分布、表面电荷、包封率和相变温度;
(4)脂质体药物的释药行为;
(5)脂质体药物特殊的表面性质;
(6)脂质体药物的稳定性;
(7)脂质体药物表征方法的准确性和适用性。
七、美国对脂质体的监管现状——FDA行业指导
2015 年,美国食品药品监督管理局发布的《脂质药品:化学、生产和控制;人类药代动力学和生物利用度;标签文件》(Liposome Drug Products: Chemistry, Manufacturing, and Controls; Human Pharmacokinetics and Bioavailability; and Labeling Documentation),进一步促进脂质体仿制药的开发。
其中讨论了申请人应在药物评价与研究中心(CDER)审查的脂质体药物产品的新药申请(NDA)或简略新药申请(ANDA)中提交哪些类型的信息。该指南没有针对根据生物制品许可申请(BLA)上市的脂质体药物产品提出具体建议,但本指南中描述的许多科学原则可能也适用于这些产品。讨论涉及脂质体药物产品的以下主题:

1. 化学、制造和控制(CMC)
(1)描述和组成
(2)物理化学性质
(3)关键质量属性
(4)制造过程和过程控制的描述
(5)脂质成分的控制
(6)药品规格
(7)稳定性
(8)制造批准后的变更
2. 人体药代动力学:生物利用度和生物等效性
(1)临床药理学研究
(2)生物药剂学
(3)标签
结语:
脂质体作为复杂注射剂中的重要一员,在药物递送领域展现出巨大潜力。通过对其定义、分类、临床应用、优缺点以及监管现状的全面分析,我们可以看到脂质体在药物递送中的独特优势和挑战。未来,随着技术的不断进步和研究的深入,相信脂质体将在药物递送领域发挥更加重要的作用,为患者带来更多福音。
<END>
 下载格隆汇APP
下载格隆汇APP
 下载诊股宝App
下载诊股宝App
 下载汇路演APP
下载汇路演APP

 社区
社区
 会员
会员



