
近年来,脂质体技术在药物传递系统中的应用日益凸显其重要性,尤其在改善药物的生物分布、降低毒性和增强靶向性方面展现出了巨大潜力。自从1995年Doxil成功上市以来,有关脂质体的研究也日趋成熟,在抗肿瘤、抗真菌、镇痛以及基因治疗领域均有了显著的突破。
在国内,脂质体制剂市场自2017年起正式进入快速放量阶段,至2020年全国医院终端市场的销售额超过70亿元。脂质体可以包载的药物包括抗肿瘤化药、基因类药物、抗体药等,未来市场空间巨大。
本文基于药融咨询《基于剂型改良的复杂注射剂分析——脂质体篇》部分内容,旨在深入剖析盐酸米托蒽醌脂质体注射液的特性、技术改进、临床优势及市场概况,同时对比分析国内其他已上市脂质体品种,以及探讨国际市场上未在国内仿制的脂质体药物,为医药领域提供全面的视角和洞见。
一、国内已上市2.2类脂质体品种分析—盐酸米托蒽醌脂质体注射液
盐酸米托蒽醌脂质体注射液是石药集团自主研发的国家2.2类新药,于2022年1月获批上市,为米托蒽醌的改良新剂型,也是全球首个上市的米托蒽醌纳米药物,获批用于既往至少经过一线标准治疗的复发或难治的外周T细胞淋巴瘤(PTCL)成人患者。
盐酸米托蒽醌脂质体注射液药品批文信息
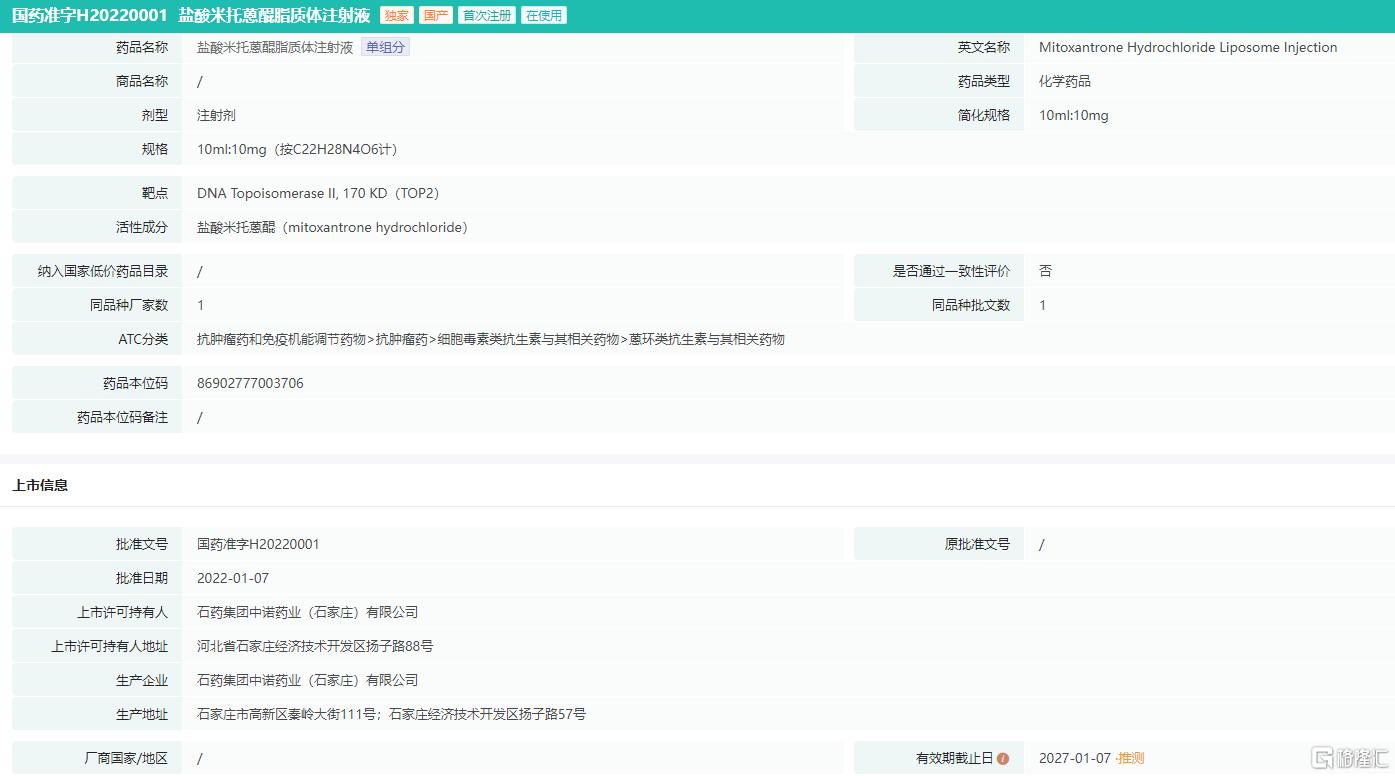
图片来源:药融云中国药品批文数据库
适应症:既往至少经过一线标准治疗的复发或难治外周T细胞淋巴瘤(PTCL)成年患者
药理作用:盐酸米托蒽醌脂质体注射液的活性成分为米托蒽醌。米托蒽醌的主要作用机制为通过氢键结合插入DNA,引起DNA结构的交联和断裂;能够干扰RNA,同时也是具有解旋和修复受损DNA作用的拓扑异构酶Ⅱ的有效抑制剂,其对体外培养的增殖性和非增殖性人类细胞均有杀伤作用,为细胞周期非特异性药物。
技术改良点:盐酸米托蒽醌脂质体,其粒径约30-80nm,含有:1) 活性成分米托蒽醌,与脂质体内的多价反离子形成难以溶解的沉淀;2)磷脂双分子层含有相转变温度(Tm)高于体温的磷脂,从而使脂质体的相转变温度高于体温。
1. 米托蒽醌改良成脂质体的必要性
(1)经脂质体包裹后,改变了米托蒽醌在体内的药代动力学特征和组织分布。该脂质体具有的60 nm粒径使其不易透过正常血管间隙,能够被动靶向肿瘤部位。
(2)其表面经甲氧基聚乙二醇修饰,使其免受网状内皮系统识别,延长血液循环时间。
(3)其在血液中包封稳定,游离药物占总药量比例恒定在1%左右,使药物在到达肿瘤组织前保持脂质体完整性,不产生药理、毒理活性。
(4)ABC转运蛋白的药物外排作用具ATP依赖性,减少米托蒽醌外排,保证胞内药物浓度,增强抗肿瘤活性。
2. 盐酸米托蒽醌脂质体制备工艺流程
(1)空白脂质体形成:氢化大豆卵磷脂、胆固醇和聚乙二醇2000修饰的二硬脂酰磷脂酰乙醇胺按3:1:1质量比溶解于95%乙醇为油相,300mM硫酸铵为水相,混合制备多室脂质体。
(2)降低脂质体粒度:微射流均质工艺降低粒度并检测。
(3)制造梯度:超滤去除外相硫酸铵,建立跨膜硫酸铵梯度。
(4)主动载药包封:按照脂药比16:1比例加入米托蒽醌,60-65℃进行载药,凝胶排阻色谱证明包封效率。
3. 盐酸米托蒽醌脂质体注射液 VS 普通盐酸米托蒽醌注射液改良后优势

(1)脂质体安全框更宽
盐酸米托蒽醌注射液:按体表面积12~14mg/m2,每3~4周一次
盐酸米托蒽醌脂质体注射液:按体表面积20mg/m2,每4周一次
(2)脂质体游离药物少,半衰期长
盐酸米托蒽醌注射液:半衰期T1/2为40~120小时,游离药物比例高
盐酸米托蒽醌脂质体注射液:半衰期T1/2为67.69~84 小时,游离与总量药物浓度比值在0.50%~2.00%
(3)安全性高
盐酸米托蒽醌注射液:静脉毒性试验死亡剂量0.9mg/kg
盐酸米托蒽醌脂质体注射液:静脉毒性试验死亡剂量3.0mg/kg
(4)临床安全性好
盐酸米托蒽醌注射液:心脏相关的TEAE发生率高(33.3%);肌钙蛋白T升高发生率高(36.7%)不良反应更多
盐酸米托蒽醌脂质体注射液:心脏相关的TEAE发生率低(26.7%);肌钙蛋白T升高发生率低(3.3%);心律失常不良事件也更低
总结:本品剂量相对于普通制剂提高了将近 50%,血液学毒性两者较接近,心脏毒性降低,其它器官系统的不良反应发生率亦降低。相当于本品的指数提高,安全窗变大。
4. 盐酸米托蒽醌脂质体注射液市场信息
盐酸米托蒽醌脂质体注射液(多恩达)获批上市后,成为石药集团获批的第二个重磅脂质体产品,同时也是国内上市的第四个脂质体产品。并于2022年1月上市,中位定价6988元,2022年销售额约0.17亿元。
盐酸米托蒽醌脂质体注射液上市2年后纳入医保,2023年国家医保谈判成功,降价60.07%, 价格降至2790元(10ml:10mg/瓶),报销适应症为既往至少经过一线标准治疗的复发或难治的外周T细胞淋巴瘤(PTCL)成人患者。
二、国内已上市其他脂质体品种分析
1. 注射用紫杉醇脂质体
紫杉醇(Paclitaxel)是应用最广泛的抗癌药物之一,其可使微管蛋白和组成微管的微管蛋白二聚体失去动态平衡,诱导和促进微管蛋白聚合、微管装配、防止解聚,从而使微管稳定并抑制癌细胞的有丝分裂和触发细胞凋亡,进而有效阻止癌细胞的增殖起到抗癌作用。
然而,因紫杉醇的水溶性差,为解决制剂问题必须使用特殊溶剂溶解药物。1992年,美国Bristol-Myers-Squibb公司以聚氧乙烯蓖麻油(CrEL)和无水乙醇为溶剂,开发了最早的紫杉醇制剂紫杉醇注射液(商品名:Taxol,泰素),其中为增加药物溶解度使用的大量聚氧乙烯蓖麻油引发了严重的过敏反应,因此所有接受Taxol治疗的患者必须预先用皮质激素、H2拮抗剂和抗组胺药物预防可能产生的致命过敏反应。
紫杉醇脂质体采用纳米技术将难溶于水的紫杉醇包封在新型药物载体脂质体磷脂双分子层中,以解决紫杉醇不溶于水的难题。紫杉醇脂质体不再使用聚氧乙基代蓖麻油溶媒,从而减少了药物不良反应(如严重过敏反应、血液学不良反应等)的发生风险,提高了肿瘤患者的耐受性。
2003年4月23日,绿叶制药以卵磷脂、胆固醇作为增溶剂开发上市新型制剂注射用紫杉醇脂质体(商品名Lipusu,力扑素),单支剂量为30 mg,另含有辅料苏氨酸和葡萄糖。
适应症:曾用过含阿霉素标准化疗的乳腺癌患者的后续治疗或复发患者的治疗;卵巢癌的一线化疗及以后卵巢转移性癌的治疗;非小细胞肺癌患者的一线化疗。
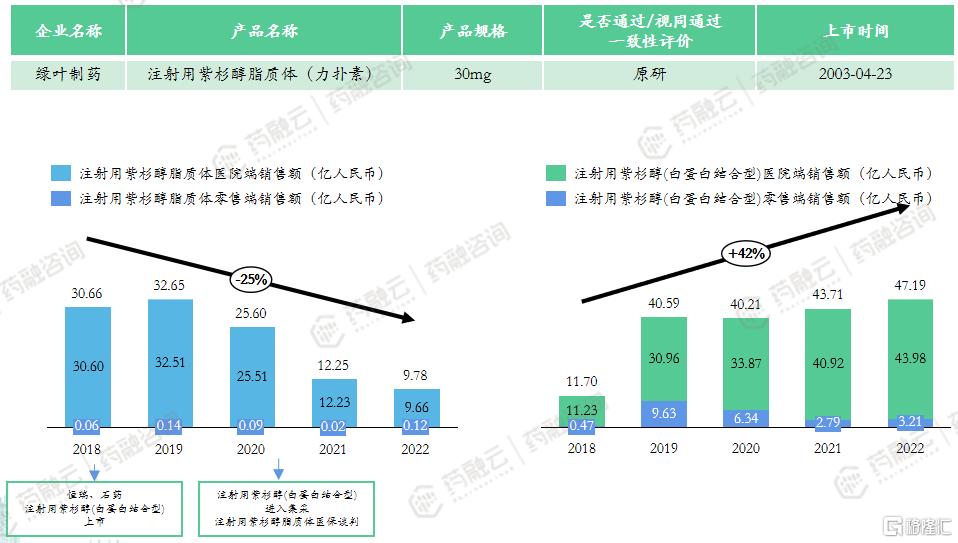
市场竞争情况:注射用紫杉醇脂质体(商品名:力扑素®),由绿叶制药自主研发,是全球首个及唯一获批上市的紫杉醇脂质体产品,目前仍处于活跃状态脂质体注射液中最早上市的产品。
目前注射用紫杉醇脂质体已纳入医保目录,采购价为228元。同品种无竞争压力,但面临着同类药的竞争压力,其市场规模受医保降价问题、注射用紫杉醇(白蛋白结合型)仿制药集采的严重冲击呈下降趋势。
2. 盐酸多柔比星脂质体注射液
多柔比星(Doxorubicin)也称为阿霉素,是蒽环类抗生素,为抗有丝分裂的细胞毒性药物,能成功诱导多种恶性肿瘤的缓解。
1995年11月,FDA批准首款抗肿瘤纳米药物盐酸多柔比星脂质体注射液(商品名:Doxil,欧洲上市商品名:Caelyx)上市,Doxil为一种无菌、半透明的红色脂质体混悬液,有20 mg/10mL和50 mg/25mL两种规格,目前适应症包括治疗卵巢癌、HIV相关的卡波氏肉瘤和多发性骨髓瘤。
盐酸多柔比星脂质体注射液由于可实现药物的增效减毒、定向聚集和精准治疗,成为全球仿制开发的热点品种之一。FDA在2013年批准了Doxil首款仿制药,由印度最大仿制药公司Sun Pharmaceutical开发,商品名Lipodox。Doxil/Caelyx在2003年经安杨森引入中国市场,但在2015年注册证号到期后未进行再注册。
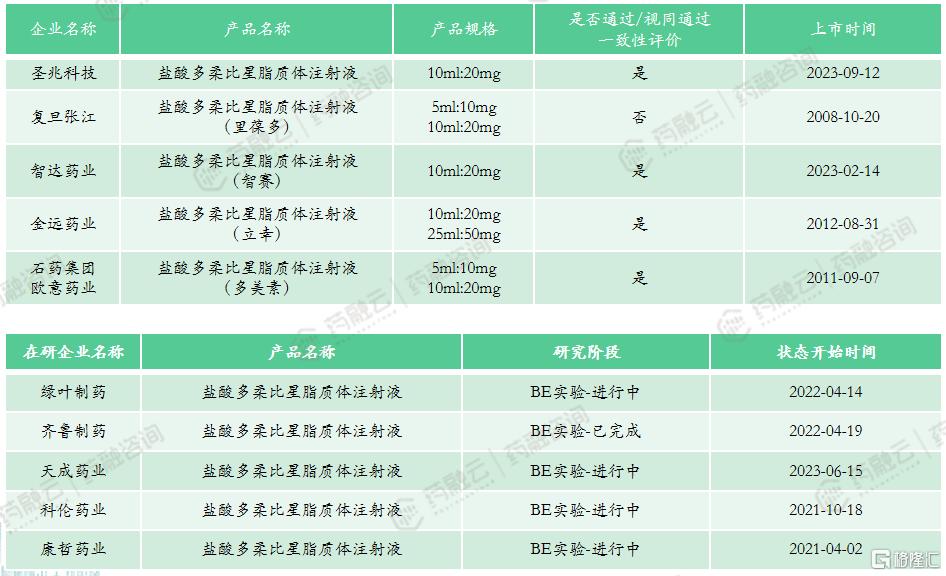
截止目前,国内市场已出现五款仿制药:上海复旦张江的里葆多、石药欧意药业的多美素、常州金远药业的立幸、恒瑞医药与智达药业合作的智赛、圣兆科技的盐酸多柔比星脂质体注射液。据药融云数据库显示,2022年全国医院终端市场注射用盐酸多柔比星销售额为2673万元,同比上涨30.15%;而盐酸多柔比星脂质体注射液的销售额为47.66亿元,份额最高的为石药欧意,占据58.29%的市场。
申报类型:3类仿制药
适应症:低CD4及有广泛皮肤粘膜内脏疾病的与艾滋病相关的卡波氏肉瘤(AIDS-KS)病人,或不能耐受下列两种以上药物联合化疗的病人。
原研上市时间:1995年11月-美国
市场竞争情况:进口产品均已退出中国市场。以10ml:20mg规格计算,2022年中位中标价为4577元;2022年全国医院端销售额47.66亿元,全国药店零售端销售额4.9亿元;本产品暂未纳入医保,4家企业通过一致性评价(圣兆科技、智达药业、金远药业、石药欧意),多家企业进行/完成BE实验,涉及齐鲁制药、绿叶制药、复旦张江等企业,未来集采可能性极高。
3. 盐酸伊立替康脂质体注射液
上市申报类型:4类、5.1类
适应症:胰腺癌
原研上市时间:2015年10月-美国
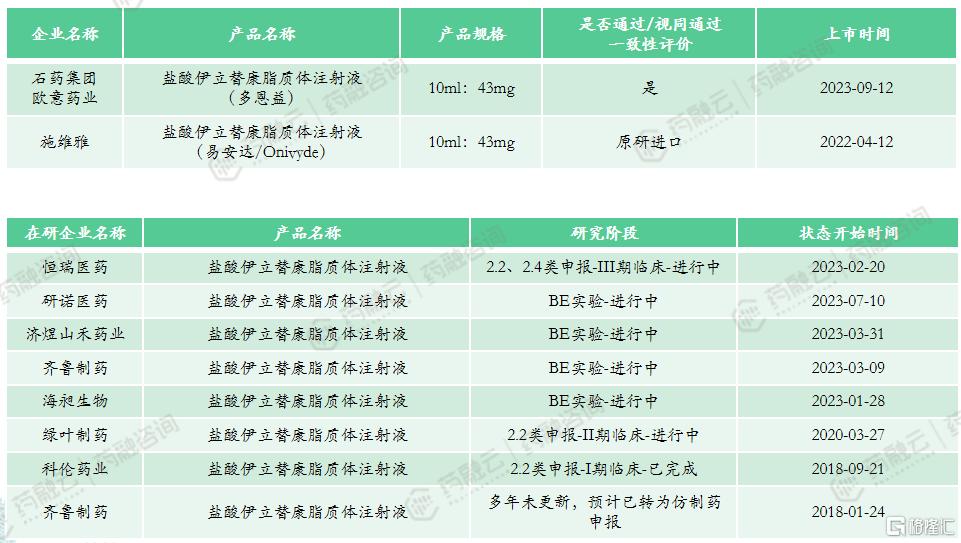
市场竞争情况:共计2款上市产品,国产产品与进口产品各1款,石药欧意的国产仿制已通过一致性评价。产品定价较高,2022年中标价为7794元,暂未纳入医保。上市时间较晚,市场竞争目前较低。多家企业申报该产品,其中恒瑞医药按2.2类、2.4类申报,希望将适应症拓展至其他实体瘤,目前进展较快,绿叶制药、齐鲁制药和科伦药业等临床进展不快。
4. 注射用两性霉素B脂质体
两性霉素 B 是广谱、强效的抗真菌药物,特别是在针对免疫功能低下人群的侵袭性真菌病、耐药真菌及少见真菌感染的治疗中有不可替代的地位。但因其不良反应大,在临床中使用受到限制。
从20世纪90年代开始,两性霉素 B 脂质体(liposomal amphotericin B,商品名:AmBisome)在侵袭性念珠菌病和侵袭性曲霉病等真菌感染治疗中获得了广泛应用。其原因是两性霉素 B 脂质体保留疗效的同时,减少药品不良反应,改善患者耐受性。
国内最早上市的注射用两性霉素B脂质体是上海上药新亚药业的锋克松,于2003年上市。2023年2月,国家药品监督管理局批准了原研企业吉利德的两性霉素B脂质体上市(商品名:安必速)。
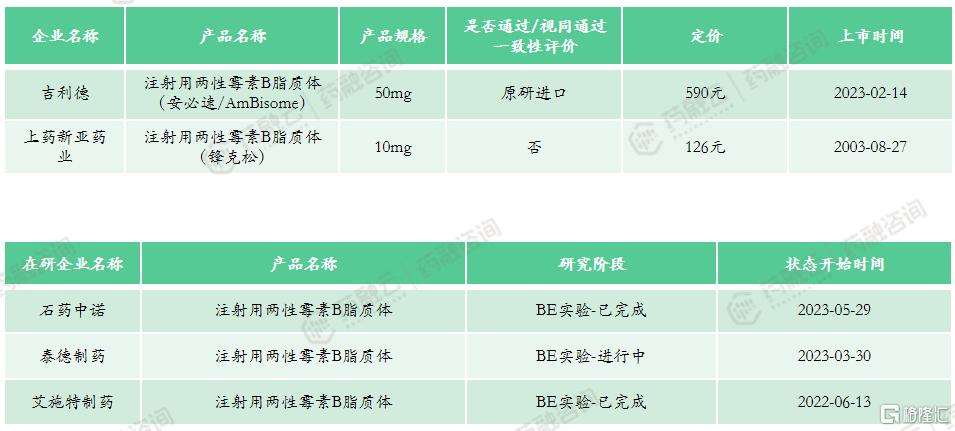
上市申报类型:原4类、5.1类
适应症:深部真菌感染、侵袭性真菌病(IFD)
原研上市时间:1990年12月-欧盟
市场竞争情况:共计2款上市产品,国产产品与进口产品各1款,医保乙类产品。2022年医院端销售额为7443万元,2022年药店零售端销售额为295万元。该产品市场规模不大,在研企业共3家,其中石药中诺、艾施特制药已完成BE实验,泰德制药BE试验正在进行中。同款产品竞争较少,未来纳入集采可能性较低。
5. 布比卡因脂质体注射液
布比卡因(Bupivacaine)上市的首款产品为盐酸布比卡因注射液,由Hospira公司于1972年开发上市,用于外科手术、口腔手术、诊断和治疗手术以及产科手术,商品名为Marcaine。
布比卡因脂质体注射液(商品名:Exparel)由Pacira公司开发,于2011年11月获FDA批准上市,用于直接注射至手术部位以帮助控制术后疼痛。Exparel起效慢,达峰时间(Tmax)12小时,持续镇痛时间长达72小时。
恒瑞制药在2020年11月启动了布比卡因脂质体的生物等效性研究,对照药是Exparel,2021年4月提交了3类仿制上市申请,目前已获批。目前科伦药业的此类产品也在BE试验中。
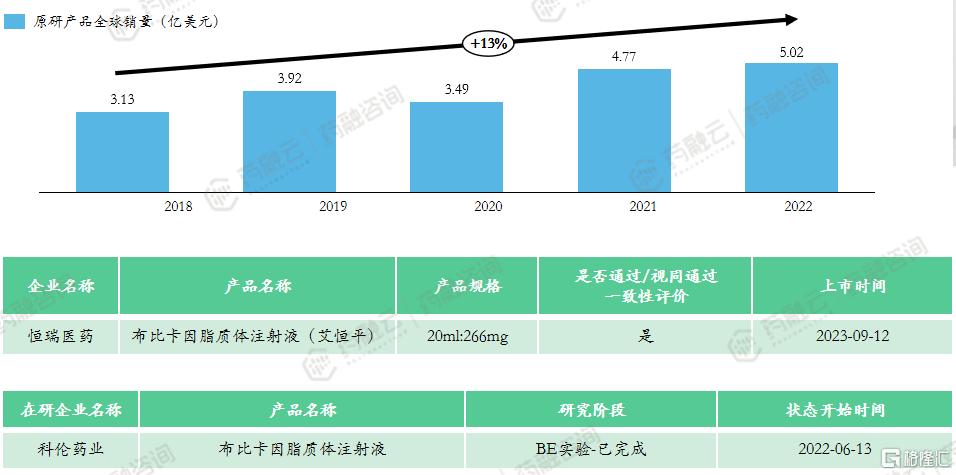
上市申报类型:3类
适应症:12岁及以上的患者单剂量浸润产生术后局部镇痛;成人肌间沟臂丛神经阻滞产生术后区域镇痛。
原研上市时间:2011年10月-美国
市场竞争情况:原研未进口,共计1款上市产品,恒瑞医药为全球首仿,已通过一致性评价。该产品2023年国家医保谈判成功,降价60.54%,2024年起定价382元。该产品技术流程中对无菌要求严格,门槛相对高,目前仅科伦1家企业布局该产品,未来市场竞争较小。
三、国际上已经上市但在中国尚未有仿制的产品
国外上市在国内未上市脂质体药物研发进展
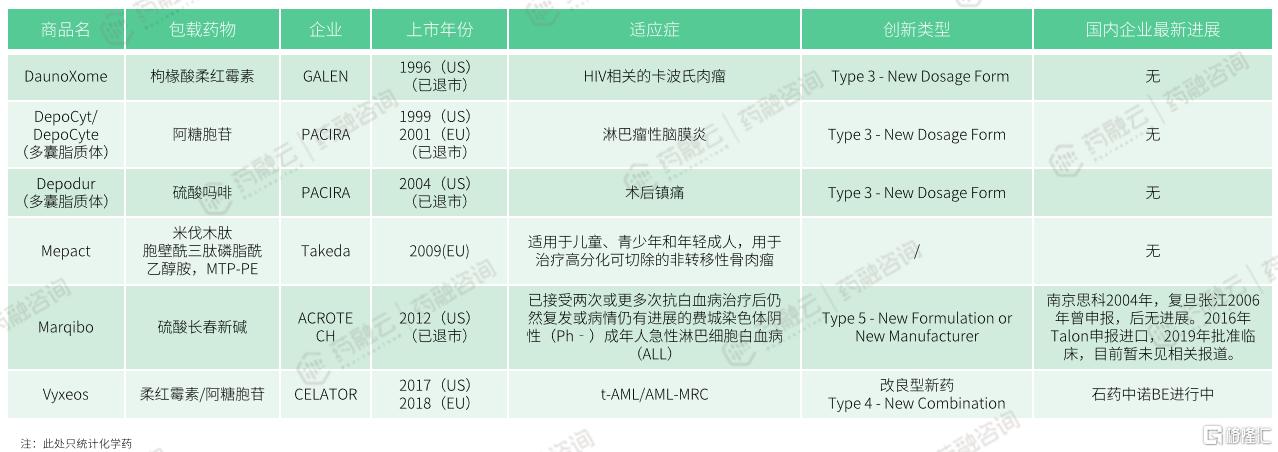
目前,在国外上市未在国内注册上市的脂质体药物,有枸椽酸柔红霉素(商品名:DaunoXome)、阿糖胞苷(DepoCyt/DepoCyte)、硫酸吗啡(Depodur)、米伐木肽(Mepact)、硫酸长春新碱(Marqibo)、柔红霉素/阿糖胞苷(Vyxeos)等。
长春新碱(Vincristine)的首款制剂是由Lilly公司开发的硫酸长春新碱注射液(商品名:Oncovin),于1963年07月10日在美国上市,但因半衰期短和神经毒性强的问题已退市。
2012年08月,FDA批准由美国Talon公司开发的硫酸长春新碱脂质体注射液(商品名:Marqibo Kit)上市,规格为5mg:5mL,用于治疗已接受两次或更多次抗白血病治疗后仍然复发或病情仍有进展的费城染色体阴性成年人急性淋巴细胞白血病(ALL)。
在国内,南京思科于2004年、复旦张江于2006年曾申报,后无进展。2016年Talon申报进口,2019年批准临床,目前暂未见相关报道。
结语:
随着国内外脂质体技术的不断进步和新药的涌现,未来脂质体药物市场将持续扩张,为患者提供更多高效、安全的治疗选项。同时,随着科技迭代与国际合作的加速,脂质体药物领域预计将迎来更多创新成果,拓宽治疗边界。对未在国内上市的国际产品追踪,也启示国内医药界紧跟全球步伐,促进自主研发与引进合作,共同推进医药健康产业的繁荣发展,惠及更广泛的患者群体。
<END>
 下载格隆汇APP
下载格隆汇APP
 下载诊股宝App
下载诊股宝App
 下载汇路演APP
下载汇路演APP

 社区
社区
 会员
会员



