海闻社讯 跌了三年的医药龙头收到了来自美国的警告信……
7月16日,恒瑞医药公司一处制剂生产场地收到美国食品和药物监督管理局(FDA)发出的警告信,本次警告信是FDA在2024年1月8日至1月16日对连云港经济技术开发区黄河路38号制剂生产场地检查结果的后续措施,与FDA网站6月初披露的公司收到的483表格为同一个关联事件。
警告信中着重提出的两大缺陷也和此前表格中的内容有所重合,包括质量控制部门在文档的监督和控制方面的履职不够,未能确保生产的制剂符合CGMP要求;设施设计不充分,用于生产无菌产品的区域没有足够的防止污染或混淆的措施。
FDA警告信是什么?
是当企业或个人违反美国《食品、药品和化妆品法案》时,美国食品和药物监督管理局发出的第一告知书。检查官员先通过相关条例进行现场检查,如果有发现存在问题,就会通过483表进行告知,相关方需要对此进行回复。如果回复不能满足监管要求,就会收到警告信。
企业在收到此信的15个工作日内,需书面详细回复FDA,提供公司为纠正和预防此类问题再次发生所采取的相应措施。在企业完成整改后,FDA会开展针对公司整改措施的审评,在FDA认为公司已解决了警告信中提及的相关问题之后,将关闭警告信。
7月17日,有投资者在互动平台向恒瑞医药提问, 你好,FDA对公司质量问题检查过程中出现的问题,公司怎么处理该问题再次发生?对于系统管理方面公司接下来怎么改进?
公司回答表示,针对FDA提出的改进建议,公司将积极组织内外专家及第三方咨询机构落实相关建议,并与FDA保持密切沟通。公司始终将患者安全放在首位,将继续坚持“质量第一,安全至上”的原则,持续完善从研发、生产到产品上市全流程管控,以高标准、严要求进行全方位产品质量管控和服务品质管理,不断精进质量管理模式。

图源:上交所互动平台
实际上,此前公司已经根据483表针对所有的缺陷项目均进行了提升整改,例如,针对质量保证(QA)缺陷问题,恒瑞表示将对文档管理软件进行风险重新评估,创建了文件销毁新程序,修订了现有程序,并对员工进行了新的培训,不过,FDA认为针对该问题还应该采取更加全面的评估和整改计划。
恒瑞医药表示,预计本次警告信对公司2024年业绩不会产生重大影响。该场地共有12个仿制药品种获得FDA上市许可,均不是公司主要产品。该场地2023年出口美国市场产品的收入为1240万美元,占公司2023年度营业收入比重约为0.39%;该场地2024年一季度出口美国市场的收入为393.88万美元(未经审计),占公司当期营业收入比重约为0.47%。
据了解,2023年,公司实现营收228.2亿元,同比增长7.26%,实现归属上市公司股东的净利润43.02亿元,同比增长10.14%。公司的营收与利润均有所修复,而在此前一年,公司的业绩是显著下滑的。
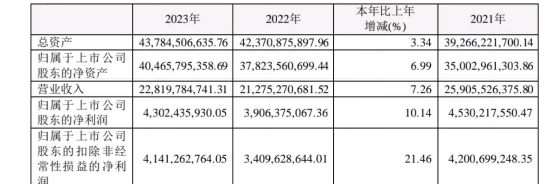
图源:公司年报
据了解,公司的生产基地遍布全国9个城市,在连云港的基地主要是国际化制剂生产基地、新医药产业园、生物医药生产基地、原料药生产基地4个生产基地。这次被警告的,仅仅是国际化制剂生产基地中,毕竟早期建成的一个场地,随着时间的推移不再符合规范。
恒瑞医药在互动平台中表示,本次警告信对公司其他生产场地无影响,目前公司出口美国的产品也未受影响。

图源:上交所互动平台
值得一提的是,恒瑞医药作为A股医药龙头,曾经三次保持季线6连阳以上,最高达到95.96元/股,市值超过5000亿元,截止日前,已经只剩下42.23元/股,市值2693亿元,萎缩超过55%。
 下载格隆汇APP
下载格隆汇APP
 下载诊股宝App
下载诊股宝App
 下载汇路演APP
下载汇路演APP

 社区
社区
 会员
会员



