
呼吸系统疾病是全球四大慢性病之一,在全球非传染性疾病导致的总死亡人数中占比达10%。我国呼吸慢病患者人数众多,防控工作迫在眉睫,随着《健康中国行动2030》的深入实施,国家层面的支持与政策导向为呼吸系统疾病的防治提供了前所未有的机遇。其中,吸入制剂作为治疗呼吸系统疾病的主要剂型,其重要性日益凸显。
药融咨询发布的中国呼吸吸入制剂行业报告《吸入制剂壁垒高玩家少,国产替代空间广阔》,旨在对吸入制剂领域进行深入分析,从领域概况、政策分析、应用领域、市场格局、产业链及发展趋势等多维度进行系统阐述,追踪行业和技术发展脉络,挖掘行业增长潜力,揭示市场发展背后的驱动因素,展望活性吸入制剂的广阔市场前景。
本文将深入探索吸入制剂的广阔天地,从其市场潜力、应用拓展、技术挑战与政策导向等多角度,勾勒出一幅呼吸疾病治疗的未来蓝图。
一、吸入制剂:未满足的医疗需求与国产替代的加速浪潮
1. 吸入制剂前景巨大,拥有众多未满足临床需求
吸入制剂是一种通过呼吸道、肺部给药的剂型,主要应用于呼吸系统疾病。在我国,有着约1亿COPD患者及6470万哮喘患者。中国COPD诊断率仅为27.2%,而美国诊断率为68.9%,中美之间COPD控制率差距也十分显著,中国为21.2%,而美国为58.5%。中国哮喘患者诊断率仅有28.8%,超过七成患者未被诊断,且治疗率仅有28.3%。对比美国哮喘患者46.7%及40.0%的诊断率及治疗率,中国COPD及哮喘诊断率及治疗率都有待提升。吸入制剂有着巨大未满足临床需求。
2. 吸入制剂国产替代加速,市场潜力巨大
吸入制剂因其药械联动性要求高,有较大的研发、临床、生产壁垒。2018年以前市场基本被阿斯利康、葛兰素史克、勃林格殷格翰等跨国企业垄断,随着吸入制剂指导原则发布及原研药专利过期,吸入制剂国产替代加速,由10%-20%的市场份额增长到50%左右,未来还会有进一步增长。
3. 吸入制剂应用领域具有广阔的拓展空间
目前吸入制剂主要集中在肺部局部作用。因肺部是直接与血液循环相连的器官,吸入制剂可以利用这一特点将药物分布到全身各部位,用于系统性疾病的治疗,如各类感染性疾病、免疫和代谢性疾病等,拥有巨大的应用前景。
二、吸入制剂的优劣势
吸入制剂起效快、药量少、生物利用度高、患者依从性好。吸入制剂是一种特殊的通过呼吸道、肺部给药的剂型。其以气溶胶或蒸汽形式,将溶解或分散于合适液体或固体介质中的原料药递送至肺部,主要用于缓解、治疗哮喘和慢性阻塞性肺病(COPD)。
由于其直接进入肺部,且肺吸收表面积大、毛细血管网丰富、肺泡上皮细胞层薄的特点,吸入制剂存在以下优势:
(1)直接进入肺毛细血管,起效迅速,且可用于蛋白、核酸等生物活性大分子给药。
(2)避免肝脏首过效应,降低给药量,减少不良反应。
(3)药物首先富集在肺部,对肺部及呼吸道疾病的防治效果更佳。
不同剂型优劣势
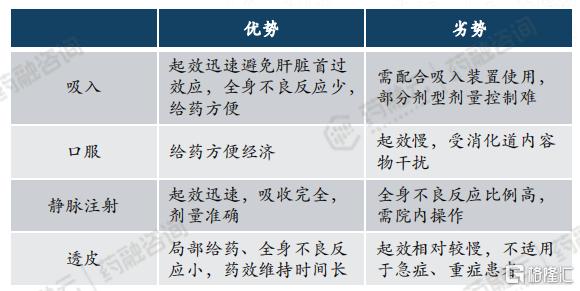
吸入制剂劣势:
(1)装置要求:吸入制剂需要特定的吸入装置,这可能增加了使用的复杂性和成本。
(2)技术壁垒:吸入制剂的研发和生产具有较高的技术壁垒,特别是药械一体的设计增加了研发难度。
三、吸入制剂的分类
吸入制剂按装置可分为气雾剂、粉雾剂、软雾剂、雾化吸入剂和鼻喷雾剂。
1. 气雾剂(MDI)
作用机制:抛射剂与含药溶液、乳液状或混悬液共同装封于具有特制阀门系统的耐压容器中,使用时借助抛射剂的压力将内容物呈雾状物喷出。
优点:便携易用、技术成熟、经济有效
缺点:需患者与设备高度协调,需要推进剂
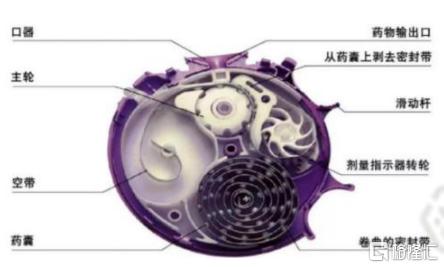
2. 粉雾剂(DPI,干粉吸入剂)
作用机制:微粉化药物与载体以胶囊、泡囊或多剂量贮存形式,采用特制的干粉吸入装置,由患者主动吸入雾化药物至肺部。
优点:肺部沉积率高,可大剂量给药,无需推进剂、便携性好
缺点:价格较高,装置内部阻塞会影响药物释放和分布,不适用肺功能较差/6岁以下儿童
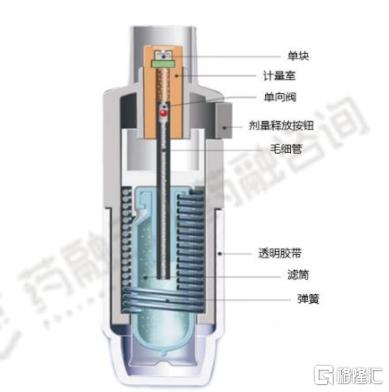
3. 软雾剂(SMI)
作用机制:压缩弹簧为驱动力的主动气雾释放,通过毛细管精准定量,同时发挥毛细管作用和液流对撞作用,释放出雾滴微细、运行速度慢、持续时间长的气溶胶。
优点:便携性好,可紧密给药,无需推进剂
缺点:装置设计复杂,药物递送量有限
4. 雾化吸入剂(NEB)
作用机制:通过气体射流原理将药物溶液转化成雾状的微小颗粒以供吸收
优点:使用简单,可大剂量给药
缺点:便携性差,需要用电,装置成本高,一剂吸入时间长
5. 鼻喷雾剂(Spray)
作用机制:借助手动泵压力将含药溶液、乳状液或混悬液呈雾状释出的制剂
优点:药物通过鼻黏膜吸收,起效迅速、局部药物浓度高
缺点:鼻干副作用,长期应用会产生药物依赖
吸入制剂按药物类型分为胆碱能受体抑制剂、糖皮质激素、β2 受体激动剂等。
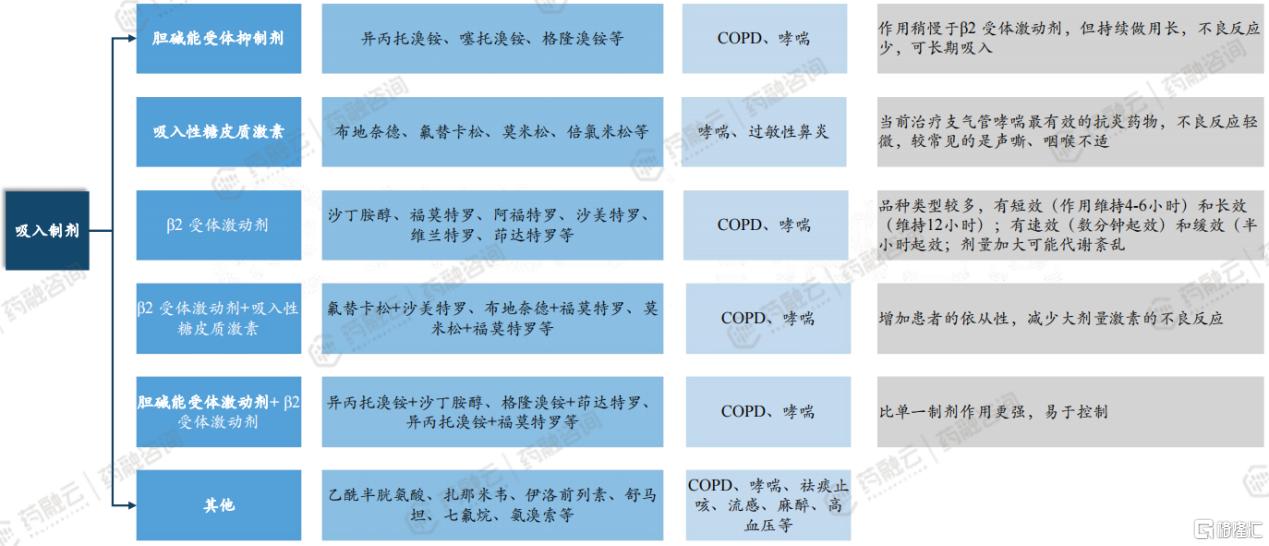
胆碱能受体抑制剂,也称为胆碱受体阻断药,是一类能够与胆碱受体结合,妨碍乙酰胆碱(Ach)或胆碱受体激动药与胆碱受体的结合,从而拮抗拟胆碱作用的药物。胆碱能受体是乙酰胆碱这种神经递质的受体,主要分为M型和N型。M型受体主要分布在平滑肌、心脏和腺体上,而N型受体则主要分布在神经系统中。
作用机制:
(1)M型受体抑制:阻断M型胆碱能受体可以减少腺体分泌、降低心率、扩张血管和减缓胃肠蠕动。
(2)N型受体抑制:阻断N型胆碱能受体可以减少神经节的兴奋传递,以及神经肌肉接头的乙酰胆碱释放,导致肌肉放松。
临床应用:
胆碱能受体抑制剂在吸入制剂中主要用于治疗慢性阻塞性肺疾病(COPD)、哮喘等呼吸系统疾病。通过抑制胆碱能神经对支气管平滑肌的兴奋作用,减少支气管痉挛,缓解呼吸困难等症状。
主要代表药物:
(1)异丙托溴铵(Ipratropium Bromide):这是一种短效的胆碱能受体拮抗剂,通过雾化吸入给药,用于缓解COPD患者的急性症状,如呼吸困难。它作用迅速,但持续时间相对较短。
(2)噻托溴铵(Tiotropium Bromide):属于长效胆碱能受体拮抗剂,每日给药一次即可维持24小时的支气管扩张效果。噻托溴铵通过干粉吸入器或软雾吸入器给药,适用于COPD的长期维持治疗,有助于改善患者的运动耐量和生活质量。
(3)格隆溴铵(Glycopyrronium Bromide):也是一种长效的胆碱能受体拮抗剂,通过减少气道阻力和改善肺功能,适用于COPD的长期维持治疗。格隆溴铵可以通过干粉吸入装置给药,与其他吸入性治疗药物联合使用时,可进一步改善患者的呼吸状况。
四、吸入制剂的发展历程
中国吸入制剂逐步打破国外垄断,进入新阶段。
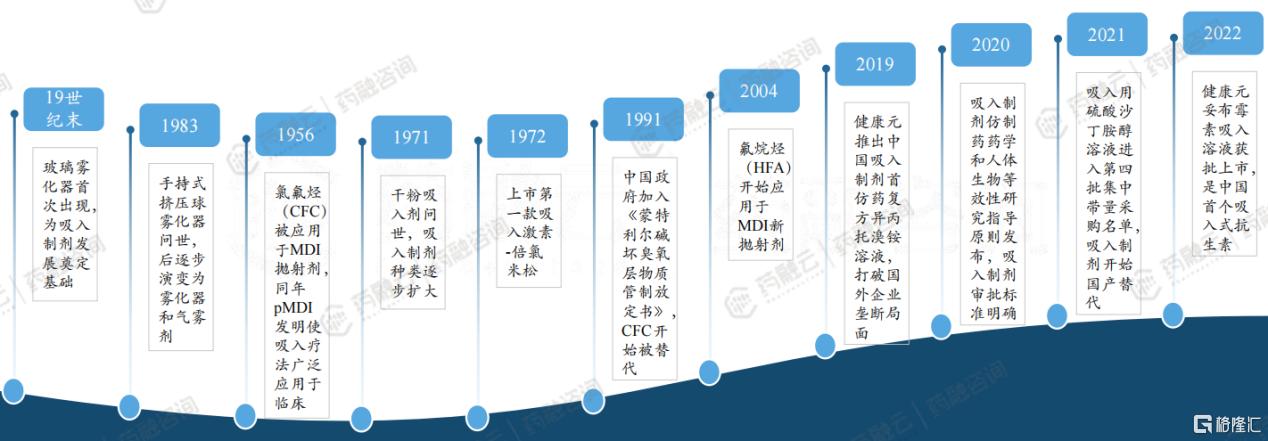
19世纪末:玻璃雾化器首次出现,为吸入制剂发展奠定基础
1983年:手持式挤压球雾化器问世,后逐步演变为雾化器和气雾剂
1956年:氯氟烃(CFC)被应用于MDI抛射剂,同年pMDI发明使吸入疗法广泛应用于临床
1971年:干粉吸入剂问世,吸入制剂种类逐步扩大
1972年:上市第一款吸入激素-倍氯米松
1991年:中国政府加入《蒙特利尔碱坏臭氧层物质管制放定书》,CFC开始被替代
2004年:氟烷烃(HFA)开始应用于MDI新抛射剂
2019年:健康元推出中国吸入制剂首仿药复方异丙托溴铵溶液,打破国外企业垄断局面
2020年:吸入制剂仿制药药学和人体生物等效性研究指导原则发布,吸入制剂审批标准明确
2021年:吸入用硫酸沙丁胺醇溶液进入第四批集中带量采购名单,吸入制剂开始国产替代
2022年:健康元妥布霉素吸入溶液获批上市,是中国首个吸入式抗生素
五、吸入制剂的研发壁垒
吸入制剂行业在研发、临床、生产仍有较大壁垒。
(1)研发壁垒
药物粒径:药物粒径是影响分布沉积率的主要因素。大于5μm粒子通常沉积在口腔或咽喉,小于0.5μm的粒子则不会停留在肺部。
药物分散状态:药物不同的分散状态(分子、胶体、微晶、无定形等)对其在肺部的沉积有不同的影响。
与载体(乳糖)的结合:加入载体可以改善高黏附性药物颗粒的流动性和分散性,乳糖是最常用的载体材料。
药械结合:吸入制剂对药械的联动性要求很高。
定量释放:必须保证给药装置每一次释放的剂量都相对稳定,对装置的性能、结构设计、质量控制等方面有较高的要求。
(2)临床壁垒
操作要求高:吸入制剂药物和给药装置一体,对患者的操作协作性要求较高,操作熟练度会影响个体吸入效果,操作不当容易出现含喷嘴过于紧密、未完全含住吸嘴、通过鼻腔吸入、吸气过快、药物沉积于口腔等问题,从而导致BE实验结果容易受到影响。
检查严格:以FDA为代表的监管机构对BE实验和临床实验要求较为严苛,审批程序环节多;国内评价体系也在进一步的探索中,也将日趋严格。
装置选择:目前国内与欧美等发达国家相比吸入制剂领域处于刚刚起步阶段,除了吸入装置的的使用需要医护人员培训外,装置选择也要根据药物因素、装置因素和患者因素对吸入治疗的影响评估后再进行,进一步加大了其临床开发的壁垒。
(3)生产壁垒
生产人员要求高:药品生产具有工艺路线复杂、生产环境洁净度要求高、设备验证苛刻、质量控制严格等特点,对生产人员和质量控制人员的专业水平、规范化意识和执业经验均有较高的要求。
批量生产不稳定:由于吸入制剂给药在微克级别,对误差的容忍度较小,且在药物粒子与装置等方面要求高,因此吸入制剂的批量化生产的过程中,很容易出现不稳定的现象。
设备昂贵:吸入制剂产业化设备昂贵,部分核心设备仍主要依赖于进口。
六、吸入制剂的政策发展
1. 国家积极推动吸入制剂发展
吸入制剂的政策发展在近年来得到了显著的推动和规范,特别是在中国,随着国家药品监管机构对吸入制剂行业的重视,一系列政策和指导原则相继出台,促进了行业的健康发展。
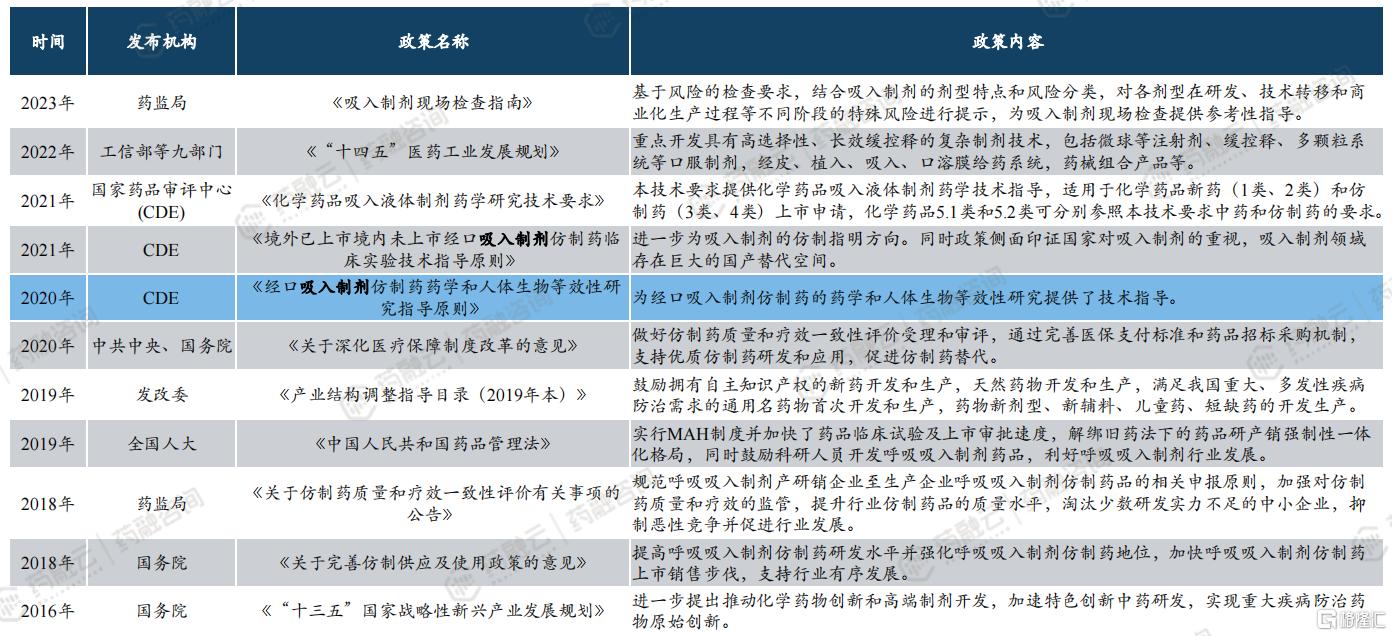
政策支持与引导:《健康中国2030》规划纲要提出加强呼吸系统疾病防治,为吸入制剂行业提供了政策导向和支持。
一致性评价:2016年起,中国启动仿制药质量和疗效一致性评价,吸入制剂作为重点品种,需完成BE试验,确保与原研药等效。
集采政策:国家药品集中采购政策的实施,推动了吸入制剂的价格下降和市场格局变化,加速了国产替代进程。
技术指导原则:2020年,中国药品监督管理局(NMPA)发布《经口吸入制剂仿制药生物等效性研究指导原则》,为吸入制剂的研发和审评提供了明确指导,标志着吸入制剂仿制药审评政策的正式落地。
绿色化学与生产:随着环保要求提升,国家鼓励吸入制剂企业采用绿色化学和生产工艺,减少污染物排放,促进行业可持续发展。
医保政策:吸入制剂中的部分创新药物和仿制药被纳入国家医保目录,提高了患者可及性,同时也对行业提出了更高的性价比要求。
2. 吸入制剂BE标准的发展与国际差异
2020年以前我国吸入制剂BE标准尚未明朗,各国监管机构对BE标准有所差异。
对于全身作用性药物,全球各地区普遍的用药代动力学研究(PK)去做BE,因为全身性作用药物通过血液循环达到作用部位。然而,对于吸入制剂这类局部作用药物,药物首先被递送到作用部位,而后进入体循环,同时还通过口、咽、胃肠道等其他部位进入体循环,药代动力学和局部递药等效性之间关系复杂,通常仅采用 PK 证明 BE 依据尚不充分。因此各监管机构对吸入制剂BE标准制定有所差异。我国仿制药指导原则中2020年以前并无吸入制剂单品指南,直至2020年《经口吸入制剂仿制药生物等效性研究指导原则》发布,我国吸入制剂仿制药审评政策才正式落地。
(1)FDA评价吸入制剂仿制产品生物等效性的证据权重法
FDA采用证据权重法进行吸入制剂的BE研究,这种方法在适当的体外研究药动学(PK)研究和药效学(PD,或临床疗效)研究所得所有数据的基础上判断给药的等效性。确保等效性以及患者对替换药物的依从性同时也考虑处方和给药装置的相似性。
(2)EMA评价吸入制剂仿制产品生物等效的阶梯式逐步方法
EMA使用逐步评估的方法进行吸入制剂的生物等效性评价。该方法将体外研究作为第一步,若体外研究结果符合特定等效标准则可直接判定两制剂生物等效;若体外研究结果不满足生物等效标准,则需要进行药动学研究,包括对肺和全身生物利用度的评估。若药动学研究结果仍不满足等效标准,则第三步使用药效学和临床终点研究证明局部生物等效性;若可通过药动学研究证明生物等效性,则不需要进一步进行大规模的药效学及临床疗效研究。
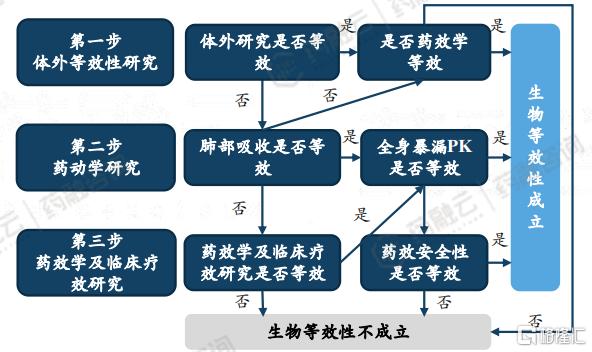
(3)中国吸入制剂仿制药生物等效性评价方法
中国吸入制剂评价等效性需进行药学研究和临床研究,总体与FDA更接近。受试制剂与参比制剂需在证明药学一致之后,进一步评价人体生物等效性,具体包括 PK-BE 研究、PD-BE 研究或临床终点研究。
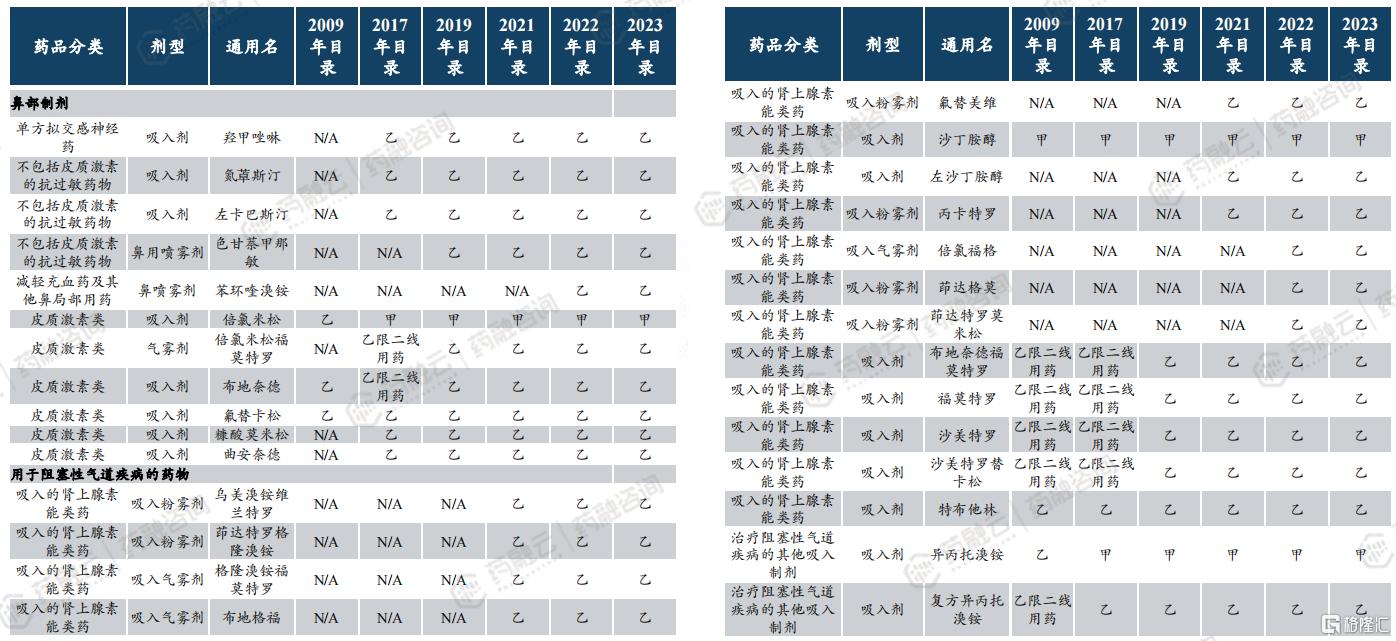
3. 医保支付端逐渐放宽吸入制剂限制
结语:
吸入制剂作为呼吸系统疾病治疗的重要工具,其发展历程见证了科技与政策的双重驱动。面对我国庞大的呼吸疾病负担,吸入制剂不仅承载着缓解临床需求的重任,也在国产替代、技术创新与政策引导下,迎来了前所未有的发展机遇。未来,相信国产吸入制剂将更好地满足临床需求,提高患者生活质量,为呼吸系统疾病的防治贡献更大的力量。
以上内容均来自药融咨询{中国呼吸吸入制剂行业报告:吸入制剂壁垒高玩家少,国产替代空间广阔}报告,如需查看全文或下载报告,可通过浏览器前往“药融咨询”网页-资源大厅-报告大厅(https://consult.pharnexcloud.com/report)搜索报告名称获取。
<END>
 下载格隆汇APP
下载格隆汇APP
 下载诊股宝App
下载诊股宝App
 下载汇路演APP
下载汇路演APP

 社区
社区
 会员
会员



