
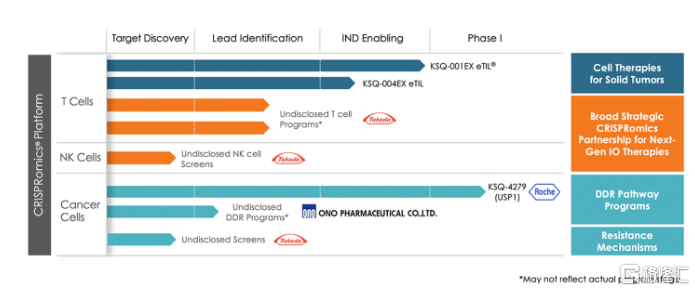
近日,临床阶段生物技术公司KSQ Therapeutics宣布美国FDA正式批准美国生物制药公司KSQ Therapeutics的TIL新疗法KSQ-001EX的IND申请。KSQ-001EX的1/2期临床研究将在美国MD安德森癌症中心开展,针对的是黑色素瘤、头颈鳞状细胞癌和非小细胞肺癌等多种实体瘤患者。

KSQ-001EX 是KSQ的领先工程化肿瘤浸润淋巴细胞 (eTIL®) 项目。KSQ-001EX 由通过CRISPR/Cas9基因编辑技术灭活SOCS1基因的TIL组成。KSQ的CRISPRomics® 平台发现,SOCS1是调节 TIL 抗肿瘤效力和持久性的关键基因,因此 KSQ-001EX 在治疗实体瘤方面具有同类最佳的潜力。
在临床前研究中,KSQ-001EX 在 PD-1 抑制剂难治的实体瘤模型中显示出更强的抗肿瘤功能,同时还增强了持久性和记忆形成。
这项1/2期临床试验是一项开放标签、安全性先导研究,对象是黑色素瘤、头颈部鳞状细胞癌(HNSCC)和非小细胞肺癌(NSCLC)患者。1期试验的主要目的是评估KSQ-001EX的安全性和耐受性。在安全性先导试验中,一组患者最初将不服用IL-2。2期试验的主要目标是评估特定适应症组群的抗肿瘤活性。
"我们的团队在推进KSQ-001EX和KSQ-004EX eTIL®项目方面取得了巨大进展。通过对平台的深入了解,我们已经确定了如何提高T细胞在治疗实体瘤中的有效性。我们相信,我们的 eTIL® 细胞疗法具有巨大的潜力,可以造福治疗选择有限的癌症患者。我们期待与MD Anderson的临床专家密切合作,这项研究将在MD Anderson启动,"KSQ 首席执行官 Qasim Rizvi 说。Qasim Rizvi表示:"我们与CTMC的合作为我们的eTIL®细胞疗法提供了强大的生产工艺,该疗法源自患者肿瘤样本,包括核心活检组织。双方的通力合作使我们能够在更短的时间内提交 IND 申请"。
美国MD安德森癌症中心的黑色素瘤医学肿瘤学教授兼KSQ-001EX研究的主要研究员Rodabe Amaria博士表示:“黑色素瘤和其他实体瘤迫切需要新的治疗选择,在临床前研究中,KSQ-001EX表现出了显著的疗效,因此很有潜力为癌症患者提供新的有效治疗选择。”
 下载格隆汇APP
下载格隆汇APP
 下载诊股宝App
下载诊股宝App
 下载汇路演APP
下载汇路演APP

 社区
社区
 会员
会员



