作者:郑薇团队(潘海洋/李扬/李沙/赵楠/赵雅韵/杨烨辉)
来源:思医辨药
【天风医药】艾德生物深度报告:伴随诊断的领导者,引领药物使用走向精准医学
摘 要
伴随诊断作为靶向创新药衍生产业链,行业景气度高
自2017年10月以来,我国创新药领域迎来发展新时代,同时衍生的创新药相关产业链也成为了市场关注的重点,艾德生物所处于伴随诊断是创新靶向药的重要环节,赛道景气度高,叠加精准医疗概念渗透到政策、业界、资本、科研等领域,目前正处于发展的黄金阶段。
站在全球的角度,2019年全球伴随诊断市场规模约35亿美元左右,到2024年预计达到73亿美元,2019年至2024年的年复合增长率将达到15.7%。这是全球体外诊断领域少有还能保持超过15%增速增长的子领域,亚洲地区是最有潜力的市场之一,未来预计将成为全球发展速度最快的地区。
我国在伴随诊断领域与国际水平平齐,从技术角度我们并未落后,甚至在某些领域超过进口品牌,实现进口替代程度较高。根据我们测算,国内当前院内伴随诊断市场规模约为9-12亿元,可估计市场空间达到30亿元,仍有2-3倍的空间可待开拓,假设5年时间达到30亿,年复合增长率约为25%。此外,随着靶向药物的发展,伴随诊断未来还有更大的空间。
艾德核心竞争力强,处于国内龙头地位
艾德通过ARMS技术沉淀,实现伴随诊断国内市场领先地位,随着公司持续投入,根据产品布局,不断进行产品迭代,未来还将持续保持先发优势,牢牢占据国内伴随诊断市场龙头位置,充分享受行业利好。
同时以荧光PCR为基础,构建一系列分子诊断检测集群,包括荧光原位杂交FISH(用于HER-2基因检测,已获批)、二代测序NGS(肺癌10基因、BRCA,已获批)、ddPCR、Sanger、免疫组化IHC等,依靠丰富的产品技术梯队,满足最大客户医疗机构的需求,构建公司核心壁垒。
产品线丰富,后续产品梯队完整
传统肺癌领域,公司已经升级至9个基因检测试剂盒,在国内PCR领域首屈一指,覆盖现有肺癌靶点,患者使用覆盖面和单价都有提升空间。此外在结直肠癌领域也推出了多基因检测试剂盒,满足临床一次性检测多基因的需求。此外BRCA产品作为未来3年主要业绩增长驱动力,将带动艾德品牌进入妇科肿瘤领域,带动一系列产品集群的进入,实现市占率提升。3-5年长周期来看,与Loxo合作共同推进临床的产品有望成为下一个重磅产品,持续推动公司业绩增长。我们持续看好艾德未来的发展驱动力。
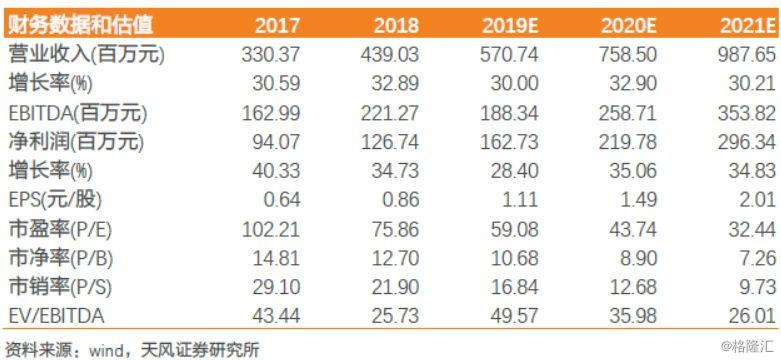
加上激励计划摊销的费用,我们预计19-21年净利润为1.63/2.20/2.96亿元,参考可比公司估值情况,2020年给予艾德生物53X估值(正文中详细分析),对应目标价78.97元,上调至“买入”评级。
风险提示:收费目录降价风险、BRCA推广不及预期、loxo临床推进不及预期等
投资要点
公司发展逻辑
伴随诊断行业景气度高,未来随着靶向药的使用,行业持续发展驱动力强。艾德生物是国内伴随诊断行业龙头企业,核心竞争力强,技术领先竞争对手,PCR领域基本实现进口替代,200多人的直销团队,牢牢卡位核心肿瘤医院,研发+渠道双协同,充分享受行业红利。
公司肺癌、结直肠癌产品保持渗透率和产品升级,还将继续保持稳健增长,新产品角度,重磅产品BRCA试剂盒和RET试剂盒(9个基因检测试剂盒,对应loxo药物)将形成产品梯队,中短期为公司业绩带来增量。中长期发展角度来看,艾德和海内外知名药厂保持紧密合作,通过临床合作,能够作为其伴随诊断试剂盒同步上市,先发优势明显,最大程度享受行业发展红利,同时艾德开始走向全球化,不再局限于国内市场,将会有更大的市场空间。
行业判断
随着靶向药加速审评上市、逐步纳入医保,合规化的基因检测必不可少,精准医疗概念逐步深化,将成为另一大产业新支柱。无论是海内外,伴随诊断都处于高速发展的黄金阶段,是体外诊断领域耀眼的明珠。2019年全球伴随诊断市场规模约35亿美元左右,未来增速将达到15.7%。国内市场根据我们测算,院内伴随诊断市场规模为9-12亿元,未来有望达到30亿元,年复合增长率约为25%。艾德占据主要市场份额,将获得主要的市场规模增长红利。
市场关注的七大问题(详见正文第5章)
1.伴随诊断空间有限?未来市场增长来源于三方面:1)传统癌种(肺癌、结直肠癌、乳腺癌、卵巢癌、黑色素瘤)检测渗透率、人均检测次数、人均客单价(使用多基因产品)持续提升;2)新靶向药的上市,其他癌症成为潜在伴随诊断使用群体;3)艾德布局全球化市场,市场空间拓展至全球。
2.ARMS-PCR技术壁垒如何?艾德自主研发的ARMS-PCR技术,通过专利和时间的积累,灵敏度不断提升,某些指标达到甚至超过进口品牌,同时开发多基因产品,技术难度大,市面上竞品很少。
3.检测项目纳入医保后的降价情况?IVD检测收费目录价格调整较为温和,企业通过产品迭代,保持毛利率水平。
4.院外样本对院内样本的冲击有多大?检测样本外流情况并不明显,我们判断2018年院外样本检测量仅占院内样本检测量的10-20%,未来院内检测才是主流。
5.NGS对现有市场的冲击?我们认为NGS是未来的一个重要趋势,但是就目前行业发展阶段而言,NGS的广泛应用仍然遇到种种瓶颈,PCR依然是伴随诊断领域重要的检测手段。(正文中作详细分析)
6.BRCA检测国内市场有多大?我们测算国内现有BRCA市场约为1.7-2.3亿元,现有竞争格局良好,假设艾德市占率为50%,在成熟阶段将每年为艾德贡献约1亿销售额。
7.艾德产品梯队如何?中短期BRCA、RET检测(对应loxo药物)贡献,长期以先发优势获得行业增长红利。
目录


正 文
1. 基本面稳健,伴随诊断龙头企业
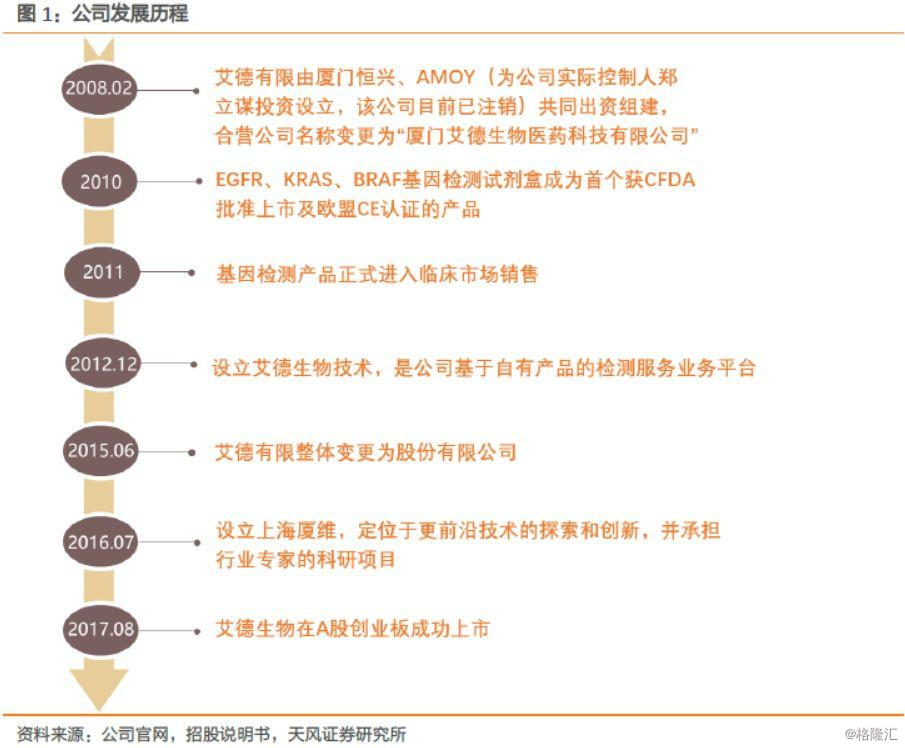
艾德生物创建于2008年,于2017年8月2日在A股创业板上市。公司总部位于福建厦门,主要从事肿瘤精准医疗分子诊断产品的研发、生产及销售,并提供相关的检测服务。公司是我国首家专业化的肿瘤精准医疗分子诊断试剂研发生产企业。
1.1. 业务定位准确,发展历程清晰
公司由郑立谋教授于2008年回国创办,2009年获得《医疗器械生产许可证》和欧盟ISO13485认证,2011年公司的核心技术ADx-ARMS®获得发明证书,在2012至2014年间,公司陆续有多种基因检测试剂盒获CFDA批准上市或用于突变检测。
2015年,公司获得《医疗器械经营许可证》,新建的艾德生物园区正式投入运营,同年获得“产品使用率名列前茅,检测准确率超过99%”的EMQN室间质评。2016年至今,公司又有多种基因检测产品和液体活检产品获批。
艾德生物由“千人计划”国家特聘专家郑立谋教授创立,是我国首家进入该行业的企业,发展至今仅11年的时间,成为一家具备丰富产品布局的上市公司,2018年营收达到4.4亿元,利润为1.27亿元,发展速度快。
1.2. 股权结构稳定,公司快速扩张
在公司上市前,据公司招股说明书,前瞻投资持有艾德生物31.45%股权,是艾德生物的控股股东。公司实际控制人为LI-MOU ZHENG(郑立谋),现任公司董事长、总经理,通过持有公司控股股东前瞻投资84.64%的股份,间接控制公司,剩余15.63%为FRANK RON ZHENG持有,其为实际控制人郑立谋之子。
公司上市后,截至2019年半年报,前瞻投资对公司的持股比例下降至23.07%,但仍保持其控股股东地位不变,其他股东持股比例均有不等比例的下降。公司实际控制人仍为LI-MOU ZHENG(郑立谋),持股比例为19.53%。
员工持股平台厦门润鼎盛(现占总股本3.58%),其71名合伙人均为公司员工,包含研发、销售、高管等职位。
上市前,公司拥有2家全资子公司,分别为艾德生物技术、上海厦维。艾德生物技术主营业务为肿瘤分子诊断技术服务,是公司基于自有产品的检测服务业务平台;上海厦维主营业务为从事生物技术领域的技术开发、技术转让、技术服务与咨询。

截至2019年半年报,公司对上海厦维的持股比例为80%(引入员工持股平台,占比20%),同时新增2家境外全资子公司:AmoyDx(Canada)Ltd.、AmoyDx(HONG KONG)Ltd.。
厦门屹祥和厦门润鼎盛的解禁时间是2020年8月,厦门屹祥持股结构中谢美群(合伙人罗菲之母,占比40.75%)、罗菲(现任公司副总经理,占比30.17%),厦门润鼎盛为员工持股平台。

实际控制人持股比例为19.53%,上市前已经具备员工持股平台,首发原股东限售股份还有5,289.84万股未解禁,解禁日期为2020年8月,短期不会带来影响。
1.3. 营收稳健增长,财务结构合理
公司营业收入总体保持高速稳定增长,从2012年的0.38亿元至2018年的4.39亿元,复合增长率50.35%;归母净利润从2012年的0.08亿元到2018年的1.27亿元,复合增长率为58.53%。2019年前半年实现营业收入2.66亿元,同比增长31.32%;归母净利润为0.78亿元,同比增长12.34%,扣非后归母净利润为0.65亿元,同比增长8.14%,业绩维持稳定增长的趋势。
2014-2015年受股份支付的影响,管理费用支出巨大,造成2014-2015年净利润增速放缓。净利润增速在2016年的大幅增长,主要是由于2014-2015年增速较慢,利润基数较低。
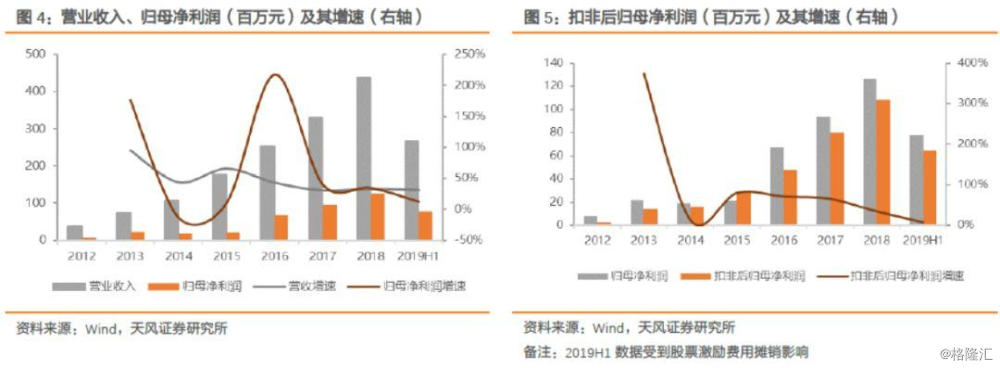
2016年以来,公司的单季度收入及利润总体维持在稳定增长水平。2019年二季度归母净利润为0.46亿元,主要是检测服务占比提升,检测服务毛利率较低,拉低整体毛利率,造成净利率同比下滑,但二季度营收达1.47亿元,同比增长29.14%,依旧维持在较高水平。

2019年前半年,公司现金流量净增加额为5463万元。2016年以来,公司的现金流量均保持在稳定充沛的数额,保障运营顺利。2017年投资活动现金流量净额大幅增加,主要是由于公司用闲置募集资金购买理财产品所致,筹资活动产生的现金流量净额大幅增加,主要是公司IPO募集资金增加所致。

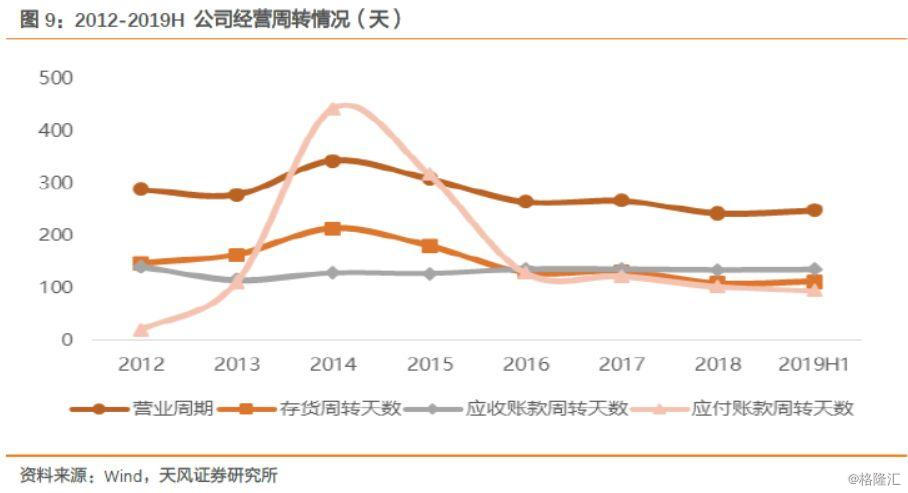
营业周期和存货周转天数自2014年开始,逐年降低,说明公司产品销售周期缩短。公司的应收账款周转天数自2012年以来,一直维持在较为稳定的水平,表明公司现金流量稳定,运营水平良好。2012至2014年,公司应付账款周转天数不断增加,说明公司在早期就具有稳定的市场地位,商业信誉良好,2014年后应付账款周转天数逐渐下降,2016年之后维持在稳定水平,也表明公司营运情况趋于稳定,资金流运转正常。
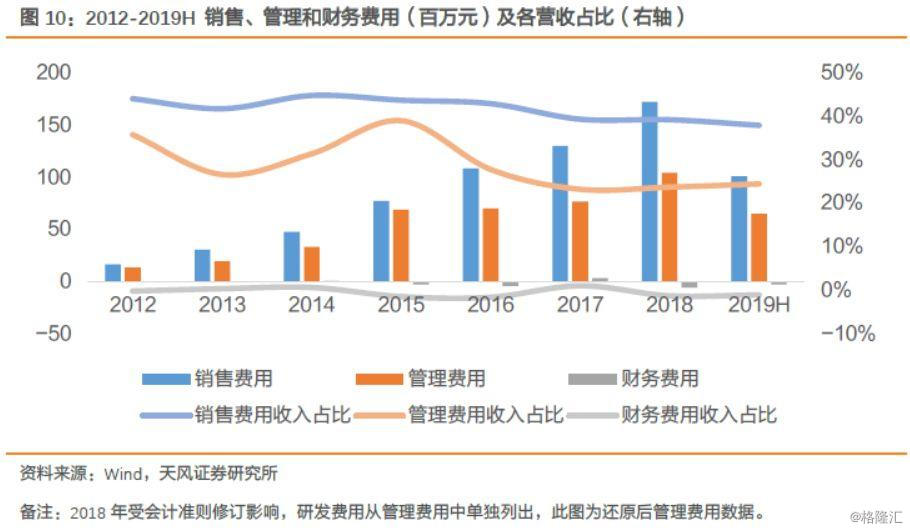
公司销售、财务费用控制合理,其中销售费用随着公司销售规模的扩大,稳步增长。2012年至2015年间,管理费用维持在较高的水平,是由于早期因公司发展需要,积极引进人才所致,从2015年之后,公司的管理费用营收占比逐渐下降。2018年国家财政部对一般企业财务报表格式进行了修订,根据修订准则的要求,利润表中新增“研发费用”项目,将原“管理费用”中的研发费用重分类至“研发费用”单独列示,所以2018年公司管理费用显示大幅降低。
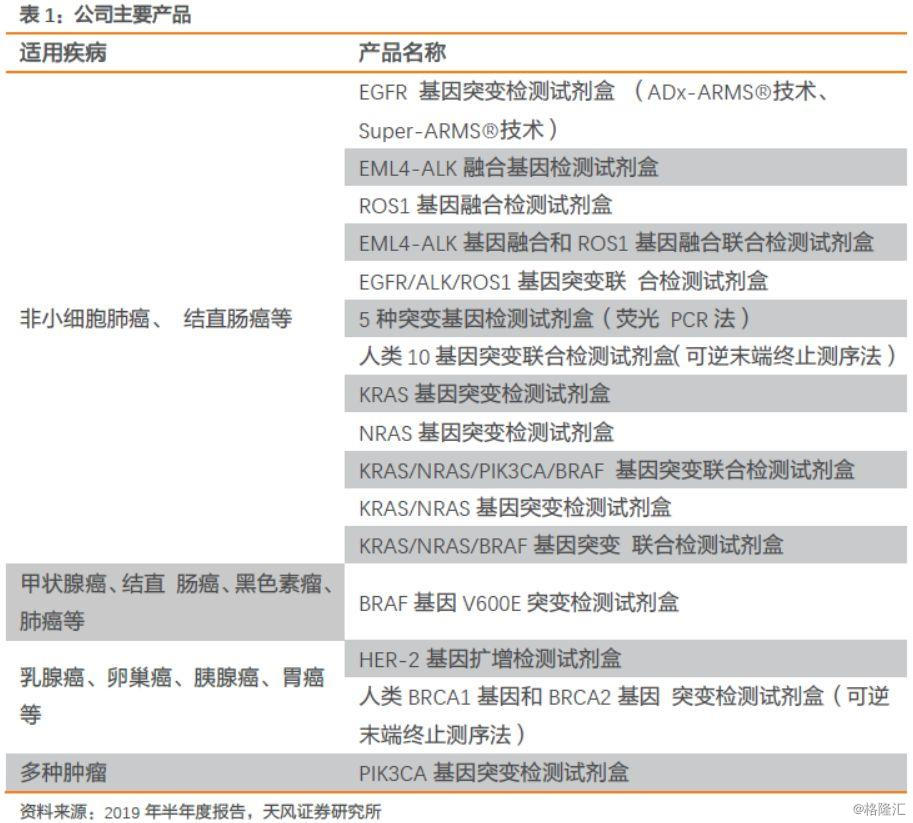
1.4. 产品覆盖面广,毛利率维持高水平
公司主营收入主要分为两个部分:检测试剂收入和检测服务收入。其中,检测试剂收入占营业总收入的85%以上,2018年占营业总收入的88.43%,为公司主要收入来源。
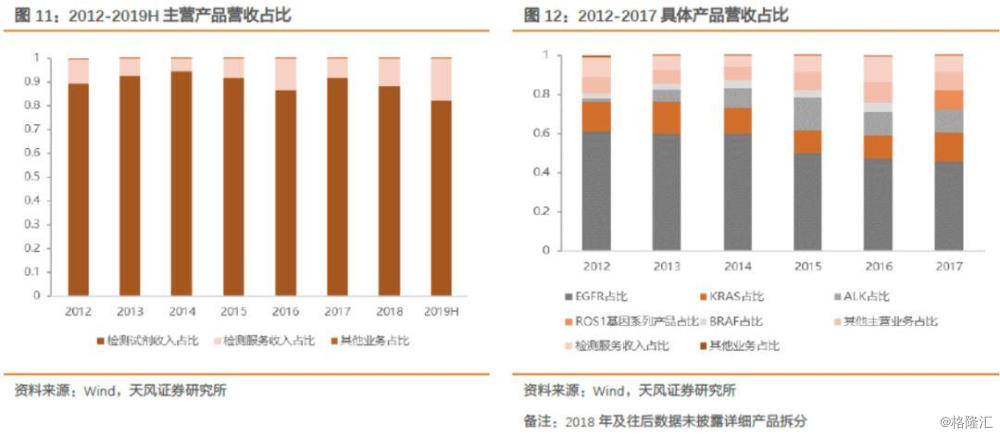
2019年上半年,检测试剂收入2.18亿元,占营业总收入的82.09%。在2012年至2017年间,检测试剂中的EGFR系列产品占总营收比例较高,达到45%以上,但呈现逐年下降趋势,主要是由于公司不断推出新产品,产品多样性可为未来营收增长提供保障。
公司主要产品具有较高的毛利率,综合产品毛利率保持在90%以上。检测试剂收入毛利率略高于综合产品毛利率,其中EGFR产品一直维持较高的毛利率,最高在2015年达到97.28%。高毛利率产品,核心竞争力强劲,保障公司业绩高速增长。公司净利率在2014-2015年有小幅下降,主要由于2014、2015年度的股份支付影响,因股份支付分别影响2014年度、2015年度的净利润209.87万元、1,171.92万元。

中国大陆市场仍然是公司的主要收入来源,其中东一区是公司的重点区域。近年来随着公司产品开始走向全球,国外市场收入有所提升,2018年国外收入为4588万元,占总收入的10.45%。
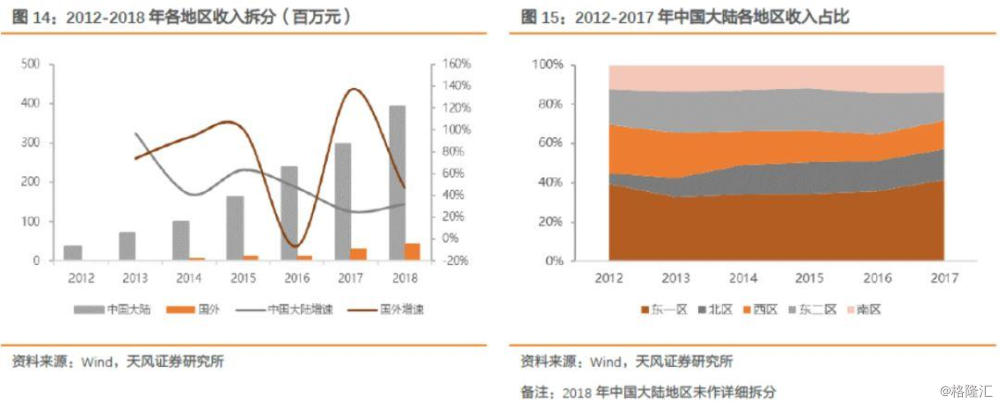
1.5. 股票激励计划充分调动员工积极性
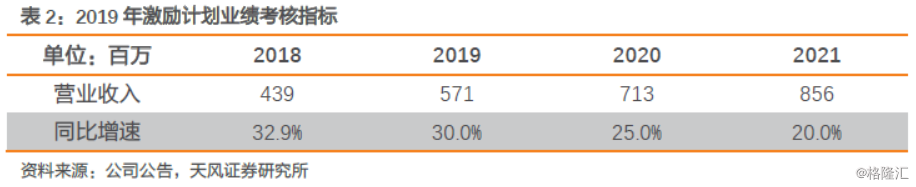
2019年公司设置限制性股票激励计划,以22.45元/股的价格向133名激励对象授予320.60万股限制性股票,包括公司公告本激励计划时在公司(含控股子公司)任职的董事、高级管理人员、核心管理人员及核心技术(业务)骨干。
此次激励计划首次授予限制性股票的解除限售考核年度为2019—2021年三个会计年度,每个会计年度考核一次,以2018年营业收入值为基数,2019-2021年营收增长率不低于30%、62.5%、95%。同时还设置了个人层面考核目标,我们认为将充分调动公司员工的积极性,实现业绩增长。
由于艾德业务属于前沿热点领域,市场处于快速发展阶段,市场推广对于专业程度要求较高。因此,公司采用“直销与经销相结合,直销为主、经销为辅”的销售模式,以保证学术推广的专业效果。公司销售团队200多人,负责全国市场营销服务工作,艾德产品已进入400多家大中型医疗机构。
2. 国内外市场空间及增长驱动力
体外诊断(IVD——In Vitro Diagnostic),是指在人体之外,通过对人体样本(各种体液、细胞、组织样本等)进行检测而获取临床诊断信息,进而判断疾病或机体功能的产品和服务。按检验原理和方法学的不同,体外诊断主要包括生化诊断、免疫诊断、分子诊断、微生物诊断、血液诊断等。
我国体外诊断行业起步于20世纪80年代初,相对国外较晚,发展初期以仿制国外的体外诊断试剂为主,在90年代初迎来了第一个高速发展的时期,诞生了一批以生产乙肝和生化诊断产品为主的厂商。经过近30年的发展,目前我国体外诊断行业已经形成一定的市场规模和技术积累,自主产品已经从最初的生化领域发展到覆盖生化、免疫、分子等多个领域、多种技术路线。据中国医药工业信息中心发布的《中国医药健康蓝皮书》统计分析,2014年,我国体外诊断产品市场规模达到306亿元,预计2019年将达到723亿元,年复合增长率达18.7%。
艾德所处的行业为药物伴随诊断,体外诊断细分下分子诊断领域当中,按照技术分类可分为PCR、二代测序NGS、荧光原位杂交FISH、免疫组化IHC等。
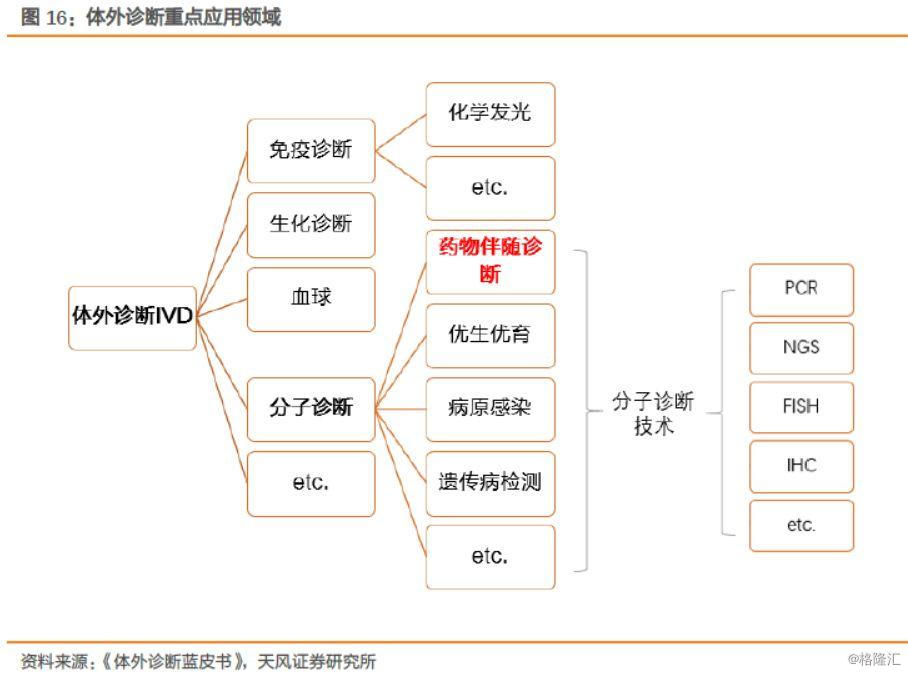
2.1. 分子诊断处于行业成长早期,精准医疗时代正在来临
国内体外诊断行业主要集中在免疫诊断、生化诊断、血液学诊断、分子诊断等领域,其中免疫诊断和生化诊断是最大的两个领域,合计占有一半以上的份额。而分子诊断目前处于成长早期,成为IVD行业增长最快的细分子行业,年增长率高达约30%。
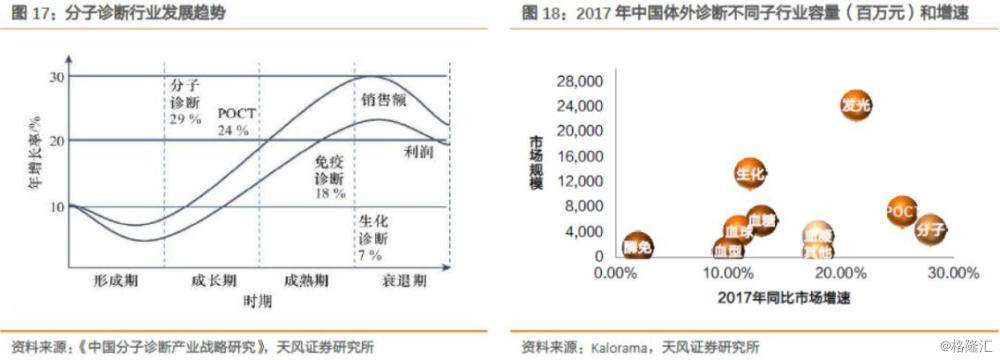
在分子诊断中,伴随诊断是其中一个重要的应用领域。伴随诊断(companion diagnostic,CDx)指能够提供患者针对具体药物的检验报告、有助于降低药物使用的风险并提高药物治疗有效率的诊断技术。伴随诊断能解决药物研发风险高、治疗应答率低的问题。精准的伴随诊断结果能为临床选择合适的靶向药物提供有力的依据,通过检测人体内差异蛋白、突变基因等,筛选靶向药物最佳用药人群,对患者进行个性化医疗。
2.2. 全球伴随诊断市场35亿美元,CAGR超15%,亚洲市场潜力巨大
跟据Markets and Markets数据,2019年全球伴随诊断市场规模约35亿美元左右,到2024年预计73亿美元,2019年至2024年的年复合增长率将达到15.7%。亚洲地区是最有潜力的市场之一,未来预计将成为全球发展速度最快的地区。

肿瘤靶向药物利用肿瘤组织或细胞所具有的特异性结构分子作为靶点,达到直接杀伤肿瘤细胞的目的,与化疗药物相比具有高特异性、高选择性、低副作用以及治疗有效率高等优点。随着肿瘤靶向药物的临床推广,肿瘤精准医疗分子诊断试剂作为其临床用药的必要诊断程序,其市场前景非常广阔。
2.3. 国内未来市场空间或达30亿人民币,增速超过25%
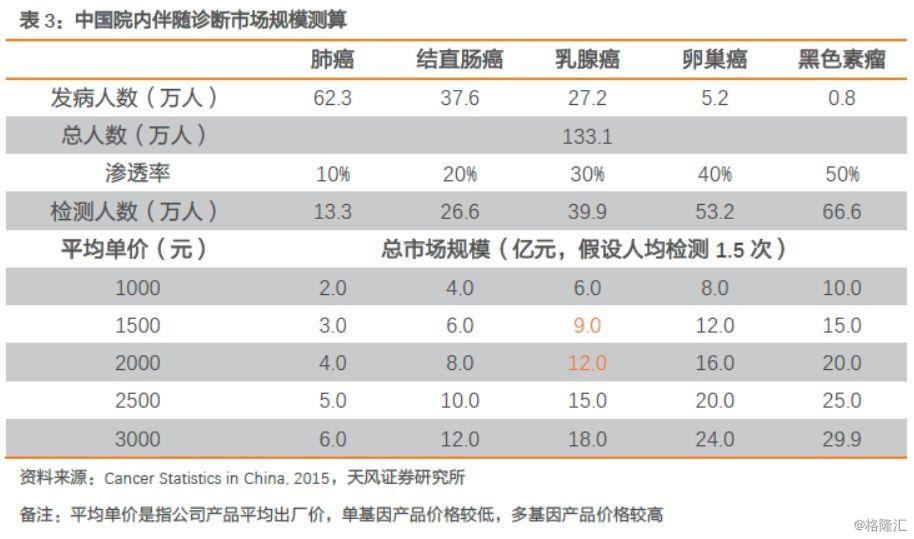
根据《Cancer Ststistics in China,2015》数据显示,肺癌发病人数和死亡人数位居第一,是中国第一大肿瘤,2015年我国肺癌新增发病人数73.3万人,其中非小细胞肺癌约为62.3万人(占85%)。根据FDA批准作为伴随诊断的肿瘤基因检测试剂盒FoundationOne CDx(F1CDx),其可作为五类肿瘤对应靶向药物的伴随诊断,包括肺癌、结直肠癌、乳腺癌、卵巢癌、黑色素瘤,2015年,我国新增这五类肿瘤发病人数合计约为133.1万人,假设伴随诊断渗透率为30%,公司出厂产品平均单价为1500-2000元(单基因产品价格较低,多基因产品价格较高,产品结构变化会带来出厂平均单价变化),人均检测1.5次,对应院内伴随诊断市场规模为9-12亿元。
根据敏感性分析,我们认为未来随着检测基因数增加,总检测客单价同向提升,同时检测渗透率的提升,未来市场空间可看到接近30亿元,假设5年时间达到30亿,年复合增长率约为25%。
以上仅为公司现有布局的市场空间测算,我们认为未来行业天花板仍可提升,基于以下三个方面:
1.靶向药跨癌种使用:随着靶向用药跨癌种临床数据的披露,对应伴随诊断潜在使用人群不在局限于以上五个癌种,例如阿斯利康的奥拉帕尼Lynparza,FDA批准其可应用于晚期上皮卵巢癌、输卵管癌或原发性腹膜癌,但是目前有不少临床数据显示,奥拉帕尼对于前列腺癌、胰腺癌、小细胞肺癌等领域具有潜在获益,未来有望能进一步拓展适应症,同时也会推动伴随诊断应用拓展至其他癌种。
2.泛癌种药物的出现:2018年11月27日,FDA加速批准Bayer和Loxo Oncology共同开发的泛癌种靶向药 Vitrakvi(larotrectinib,拉罗替尼)上市,用于治疗携带NTRK基因融合的局部晚期或转移性实体瘤的成人和儿童患者。临床数据显示,具备NTRK基因融合的多癌种患者群体总体有效率为75%,这是一个泛癌种药物的标志性事件,未来随着更多泛癌种靶向药的出现,伴随诊断潜在检测群体将扩散至全癌种。
3.液体活检技术的成熟提高检测频次:当使用靶向药耐药以后,由于肿瘤细胞已经扩散、组织取样无法实现等原因,液体活检成了肿瘤突变检测的重要手段。随着各种治疗方案的完善,癌症五年生存率逐步提升,癌症正逐渐走向“慢性病”,靶向药物治疗多次检测成为可能,将推动伴随诊断市场规模成倍扩张。
总体而言,从现有伴随诊断发展趋势上来看,国内当前院内伴随诊断市场规模约为9-12亿元,可估计市场空间达到30亿元,仍有2-3倍的空间可待开拓,假设5年时间达到30亿,年复合增长率约为25%。此外,随着靶向药物的发展,伴随诊断未来还有更大的空间。
3. 艾德核心竞争力突出,处于市场领导地位
3.1. ARMS-PCR优势明显,艾德做到极致
公司具有自主知识产权的核酸分子检测技术(ADx-ARMS®)是目前国际上肿瘤精准医疗分子诊断领域领先的技术之一,在肿瘤相关基因突变检测方面具有敏感、特异、简便、快捷的优点,适合于各种检测样本,并可用于多重基因高通量检测,达到行业公认的国际先进水平。
经过多年发展,艾德将PCR伴随诊断领域产品做到极致,多个产品的市占率接近七成,牢牢把握院内渠道资源,为后续产品上市提供市场基础。
我们认为艾德能够在PCR领域突出重围,并且占据较大的市场份额,基于以下方面:
1.PCR作为分子实验室基础的仪器设备,使用较为普遍,对于操作人员要求并不高,利于产品推广。相比于其他各类PCR技术,ARMS技术操作简单,实验步骤较少,并且灵敏度高,能够满足伴随诊断的要求。
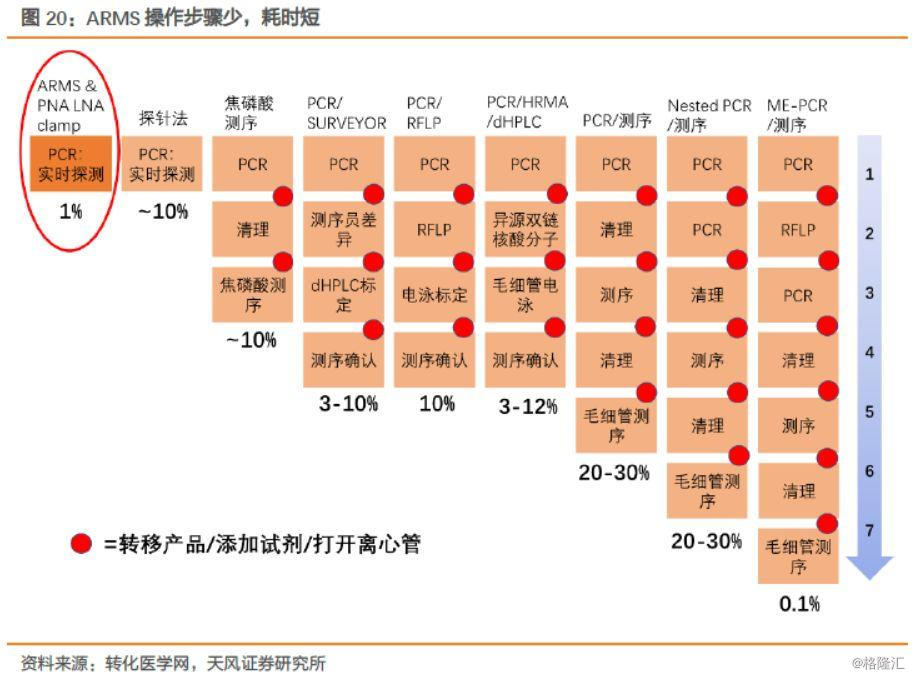
2.基于ARMS技术平台,公司开发产品丰富。公司持续推出高性价比、高可靠性、高质量的伴随诊断产品,由单基因逐步升级为多基因,目前艾惠健产品是艾德主推产品之一,完全满足肺癌一线核心驱动基因的快速检测需求,在检测基因数量上具备优势,后来者追赶需要一定的时间。根据2018年报,公司陆续研发了22种单基因或者多基因联合检测试剂,多为我国首批取得国家药监局(NMPA)医疗器械注册证书和通过欧盟CE认证的产品,依托先发优势占领市场,教育终端形成品牌粘性,构建产品和销售上的壁垒。

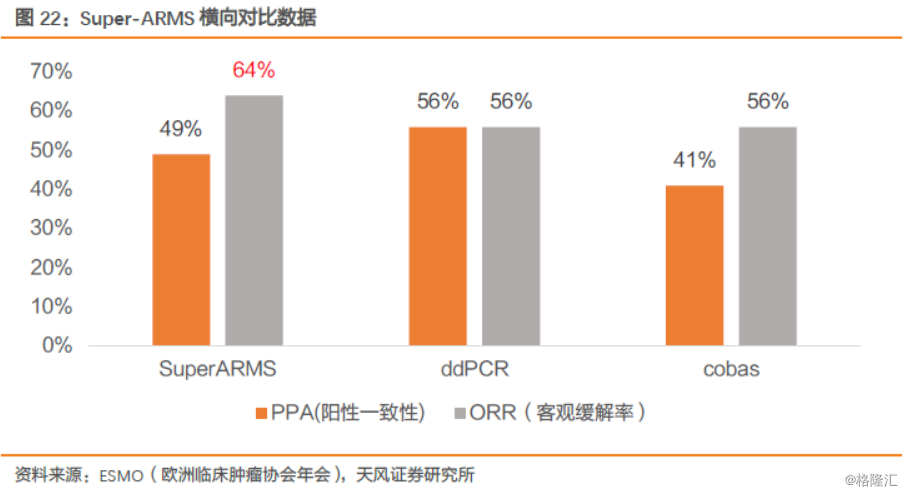
3.艾德在ARMS-PCR技术上不断深耕,有望在未来液体活检中持续保持先发优势。艾德ARMS-PCR灵敏度进一步提高,已经达到了1%的灵敏度水平,处于国际先进水平。2018年初国内获批上市的EGFR液体活检伴随诊断试剂盒,公司应用了升级版的ADx-SuperARMS技术,灵敏度进一步提升至0.2%,超越竞争对手。根据ESMO披露数据,Super-ARMS技术检测血浆T790M突变的阳性检出率仅次于目前灵敏度最高的ddPCR技术,但是Super-ARMS技术检出的血液T790M突变阳性患者奥希替尼的客观响应率(ORR)最高,高达64%,说明灵敏度0.2%的Super-ARMS技术是临床血液ctDNA检测的最优选择,疗效预测的准确性最高,是血液检测临床应用的可靠技术。
液体活检是未来的肿瘤检测趋势之一,艾德已具备技术基础。液体活检技术可将伴随诊断市场延伸到肿瘤时间线的后半段,包括用药检测、耐药指导等领域,将推动伴随诊断市场空间或成倍扩张。
Guardant Health(GH.O)
液体活检同时也受到了全球投资者的关注。液体活检明星公司Guardant Health(GH.O),成立于2013年,是世界领先的综合性液体活检公司之一,也是第一家将全面的基因组液体活检商业化并获批的公司,市值接近70亿美元。
2014年推出了其第一个商用癌症血液检测产品Guardant360,这个产品仅需2小瓶10ml血就可以做非侵入式的癌症筛查,能检测出肿瘤的基因变异,临床医生一周后就能收到检测报告。Guardant360可以检测73个基因,针对晚期实体瘤癌症患者提供靶向药物筛选,同时也被获批为阿斯利康奥希替尼药物的伴随诊断试剂盒。获批至今已被使用超过80000次。
另一重要产品GuardantOMNI于2017年推出,应用于科研使用,包含基因数更多,达到500个基因,同时还可以检测与同源重组修复缺陷相关的基因和免疫治疗的生物标记,如肿瘤突变负荷TMB和微卫星不稳定性MSI。GuardantOMNI比Guardant360灵敏度更高,2018年12月获得FDA的突破性设备指定,目前正在开发中,包括作为潜在的伴随诊断,以识别可能受益于免疫治疗的患者。

Guardant360的获批上市以及广泛使用,表明了液体活检的可靠性和准确性,并且其易操作性受到临床医生和患者的青睐,成为伴随诊断的新方式。GuardantOMNI不断有新的临床数据披露,显示其强大的检测能力,甚至能够识别TMB和MSI指标。Guardant Health的发展为我们展示了液体活检的可能性,艾德目前在国内液体活检领域走的最前,技术成熟,率先拿下国内ctDNA第一张批件,未来有望在液体活检领域保持先发优势。
基于以上分析,我们认为艾德通过ARMS技术沉淀,实现伴随诊断国内市场领先地位,随着公司持续投入,根据产品布局,未来还将持续保持先发优势,牢牢占据国内伴随诊断市场龙头位置。
3.2. 全面布局NGS基因测序领域,蓄势待发
从获批NGS试剂盒基因数上来看,艾德在NGS领域处于国内第一梯队。截至目前,国内有五个公司的NGS试剂盒获批上市,对比而言,艾德试剂盒适用癌种拓展至结直肠癌领域,检测基因数为10个基因,目前最多的基因数检测,对应伴随诊断药物拓展至西妥昔单抗,能够满足临床多样性的需求,较其他试剂盒竞争力更强。


投资布局上游测序仪,战略布局目光长远。2018年5月,公司公告拟以自有资金8,000,000美元购买UST公司发行的1,509,595股优先股,每股购买价格约为5.30美元。交易完成后,占UST公司已发行股份总数的18.986%。Universal Sequencing Technology公司是一家专业从事基因测序平台研发及产业化的高科技生物技术公司。UST公司尚处于研发及产业化推进阶段,相关产品还未实现量产和对外销售。
我们始终认为NGS是未来肿瘤伴随诊断不可或缺的一项重要技术,从成熟的美国市场上来看,NGS占据着重要的地位,同时PCR也是一项不可或缺的检测技术。就国内目前行业发展阶段而言,PCR依然处于快速发展阶段,NGS尚处于发展早期,并且从未来发展趋势上面来看,PCR并不会被NGS所替代,二者作为临床医学检测重要手段,将会共同存在于市场。
3.3. 以临床需求为先,定位综合性解决方案供应商
艾德以荧光PCR为基础,构建一系列分子诊断检测集群,包括荧光原位杂交FISH(用于HER-2基因检测,已获批)、二代测序NGS(肺癌10基因、BRCA,已获批)、ddPCR、Sanger、免疫组化IHC等,满足各类临床需求。
需求端:伴随诊断最大的客户是医院,医院客户需要的是一整套解决方案,最终得到一个准确的结论,而并非像科研机构一般追求技术的先进性。荧光定量PCR技术经过数十年的发展,已经成为医院分子诊断的成熟方案,荧光定量PCR仪也成了分子检验科的标配,基于仪器基础,艾德通过qPCR突破医院客户群体,建立终端信任,同时根据医院客户需求,配套结合其他分子诊断技术,牢牢掌握终端需求,目前国内院内市占率约为70%。
合作方:伴随诊断和靶向药密不可分,靶向药厂家通常会选择外部伴随诊断企业共同开发,术业有专攻,一般会基于伴随诊断厂商的技术是否可靠、终端应用是否广泛、品牌知名度如何、报证经验如何等方面,艾德在院内的市占率水平在合作过程中具备明显优势,有利于加速临床入组,熟悉报证环节,无缝对接产品推广,和国内外知名药企保持紧密合作。早期介入药品研发,和药品同期上市,获得药品早期快速起量阶段的先发优势。

公司持续保持高额研发投入,2018年研发投入费用达到7834万元,多年来研发投入占比维持在15-20%之间,高强度的研发投入保证产品持续保持竞争力,跟紧产业发展趋势。
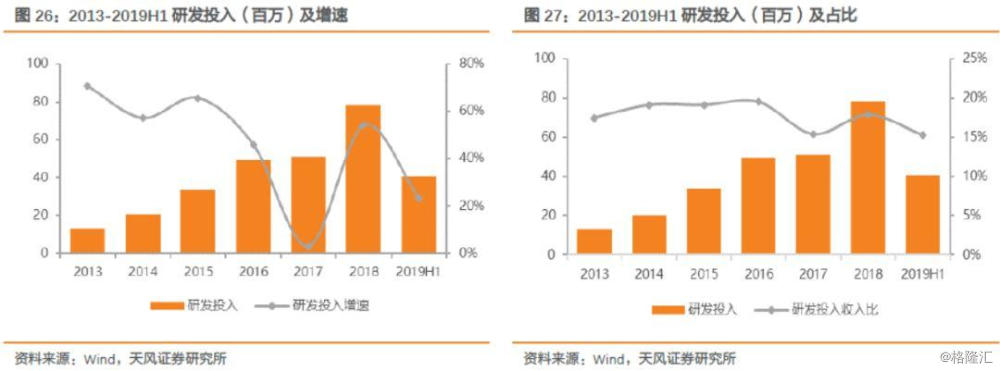
艾德在qPCR领域做到极致,实现进口替代,市占率达到70%,持续具备核心竞争力。尽管NGS火热的时代,艾德依然稳扎稳打,牢牢掌握院内主动权,顺应趋势推动技术变革,依靠丰富的产品技术梯队,满足最大客户医疗机构的需求,构建公司核心壁垒。
4. 重点产品情况
4.1. 肺癌:大病种大市场,公司重点收入来源
肺癌是全球最常见的恶性肿瘤,死亡率在恶性肿瘤的首位,其中约85%为非小细胞肺癌(Non-Small Cell Lung Cancer,NSCLC)。我国的肺癌发病率一直都在全球前列,国家癌症中心根据2009-2011年间72个肿瘤登记处上报的、覆盖全国8550万人口的数据预测,2015年中国新发肺癌人数达到73.3万人。
肺癌的诊疗模式是根据驱动基因状态选择靶向治疗,靶向药物针对特定基因型肺癌展现出的高药物应答率、明显延长的生存时间和较轻的毒副反应等表现,推动了肺癌治疗走向以基因为导向的精准医疗之路。
目前,血液中的ctDNA已被证实可用于评估肿瘤基因突变状态来预测靶向药物疗效。对于无法获取足够组织或细胞学样本的晚期肺癌患者来说,方便、无创的血液样本已成为基因检测的最佳样本。随着临床对于基因检测需求的持续增加,业已形成从单基因检测到多基因联合检测、从组织或细胞学样本检测到血液等液态活检样本检测的发展趋势。
NSCLC已知驱动基因已有十多种,累计发生于约70%的病人,针对性靶向药物也越来越多。一次确诊单个基因突变状态的逐一筛查模式已经无法满足为晚期NSCLC患者制定合理治疗方案的需求,因此多基因联合检测将成为NSCLC患者筛查的主要方式。

EGFR突变、ALK融合、ROS1融合检测目前已被写入国内外多个权威诊疗指南或专家共识,明确了NSCLC在治疗前应该同步检测EGFR、ALK、ROS1三个基因状态的临床要求。2017年更新的《肺癌患者TKI靶向治疗分子检测指南》中,明确提出所有肺腺癌患者都必须常规检测以上三个基因,并且BRAF、MET、HER2、KRAS和RET基因虽然不作为常规单检项目,但应该作为多基因检测套餐,与EAR三基因同步检测或在EAR三基因结果均为阴性后检测。
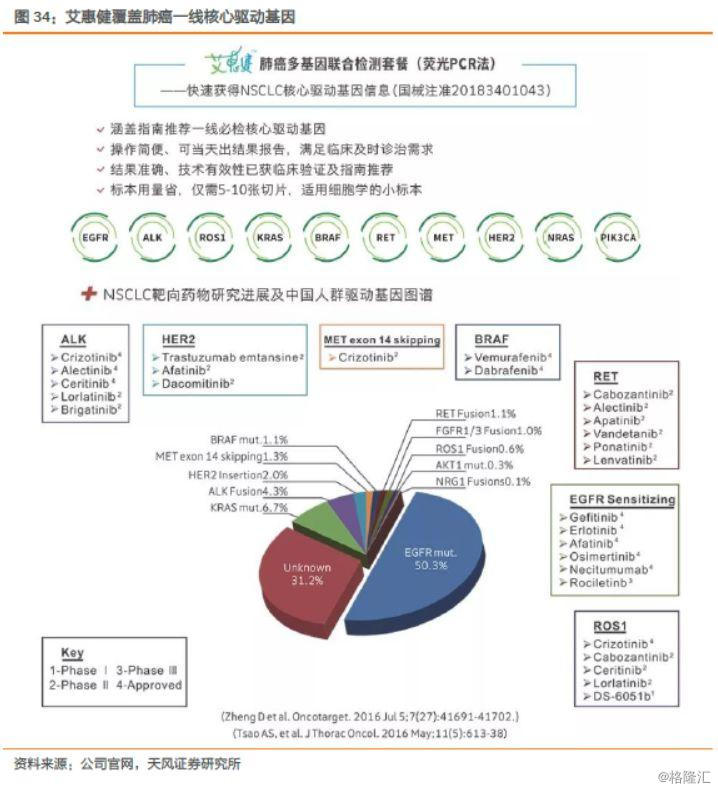
公司的5种突变基因检测试剂盒(荧光PCR法)——艾惠健™,能够完全满足肺癌一线核心驱动基因的快速检测需求;人类10基因突变联合检测试剂盒(可逆末端终止测序法)——维惠健™,基于自主核心专利技术ddCapture®——NGS技术平台,获批可用于肺癌、肠癌两个癌种的5个药物伴随诊断,覆盖了肺癌、结直肠癌目前已上市及未来3-5年可能上市靶向药物所有的治疗靶点。
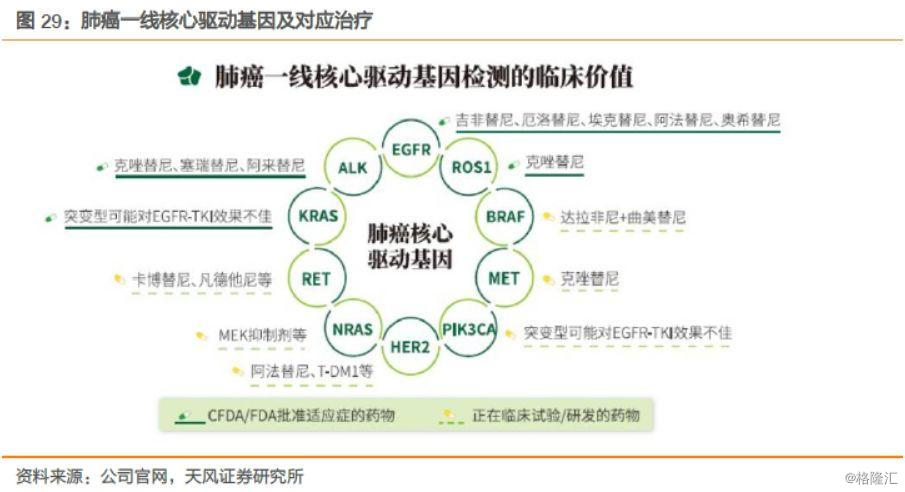
一线检测的临床价值在于能够快速获得准确且有价值的核心治疗指导信息,这一点对于晚期NSCLC患者有重要意义。
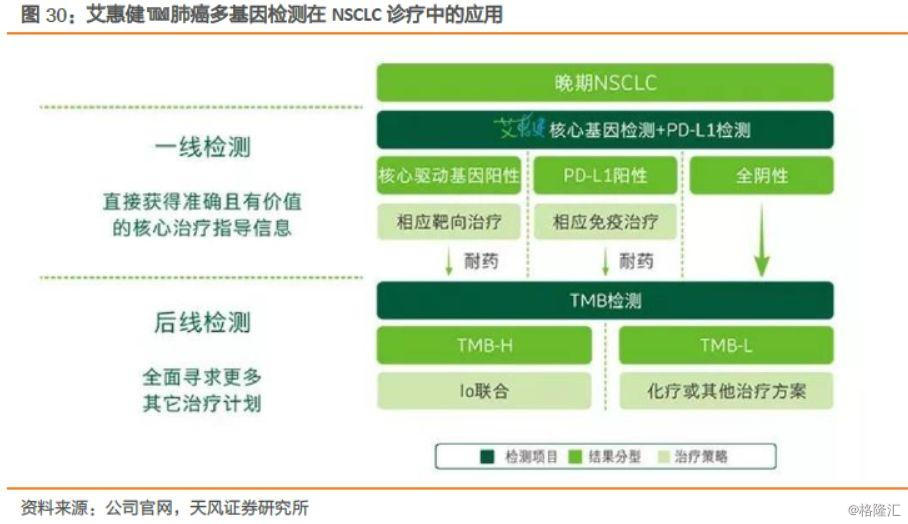
4.2. 结直肠癌:伴随诊断意义逐步得到重视,使用量提升
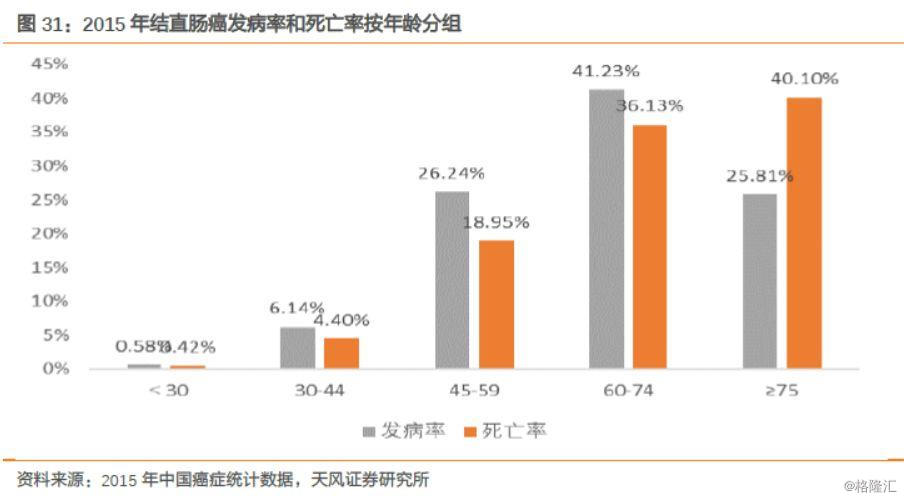
结直肠癌是全球第三大常见恶性肿瘤,在我国呈逐年上升趋势,数据显示我国2015年结直肠癌的新发病例数为37.63万人,在年龄上,发病率整体上呈现正态分布趋势,主要集中在60~74岁的年龄范围,占总体发病人数的41.23%,而45岁以上发病的患者占所有结直肠癌新发病例的93.28%。死亡率方面,45岁以上结直肠癌患者的死亡率为95.18%,整体表现为随着年龄增长死亡率逐渐提高的趋势,其中60~74岁和75岁以上年龄段的死亡率分别为36.13%和40.10%。
随着2016年度国家精准医学重大专项科研项目结直肠癌诊疗规范及应用方案的精准化研究正式启动,中国结直肠癌预防、诊断、治疗将全面向规范化精准医学模式进发。传统的治疗方案已不能满足医疗所需,在精准医疗的指导下,结直肠癌已经进入了靶向治疗时代。
表皮生长因子受体(epidermal growth factor receptor, EGFR)与血管生成,肿瘤细胞增殖,侵袭,转移及细胞凋亡的抑制相关,结直肠癌的靶向治疗药物为抗EGFR的单克隆抗体。在接受EGFR单克隆抗体治疗前,需强制性检测肿瘤组织的RAS(KRAS、NRAS)、BRAF突变基因状态。RAS突变是目前仅知的具有真正临床意义的EGFR单抗治疗mCRC的独立耐药预测因素。此外BRAF、PIK3CA、EGFR、HER2等基因可能与EGFR单抗治疗mCRC的原发性及继发性耐药相关,依据这些基因的改变可预测EGFR单克隆抗体的疗效。
基于公司PCR技术平台的人类KRAS/NRAS/BRAF基因突变联合检测试剂盒(荧光PCR法),目前已获得CFDA批准可同时检测KRAS、NRAS和BRAF三种基因。KRAS、NRAS、BRAF都是EGFR下游的信号分子,是众多信号通路上关键的激活因子,在结直肠癌患者中的突变率分别为20~50%、1~6%、8~15%。KRAS、NRAS、BRAF基因突变一般会使结直肠癌患者对抗EGFR抗体类药物产生耐药。
4.3. 乳腺癌/卵巢癌:重磅药物疗效显著,伴随诊断竞争格局良好
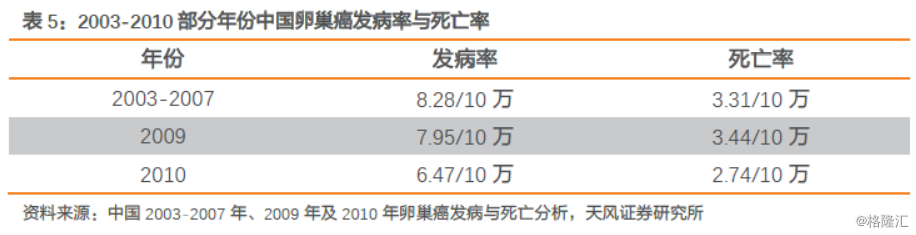
乳腺癌是目前女性最常见的癌症,也是中国女性第六大主要的癌症死因。统计数据显示,全球每年约有140万人被诊断为乳腺癌,死亡约50万人。根据《中国癌症发病与死亡2003-2007》及《中国肿瘤》杂志刊登的数据显示,2003~2008年我国女性乳腺癌发病率从21.17/10万上升到了26.26/10万,涨幅为17.65%;2009年发病率稍微有所下降,但2010~2012年,发病率又急剧上升至30.43/10万,较2003年涨幅高达43.74%。我国2015年新发乳腺癌病例高达27.2万人,死亡约7.1万人。
卵巢癌是女性生殖系统最常见的恶性肿瘤之一,发病率仅次于宫颈癌和子宫内膜癌,但死亡率最高。2015年我国约有52,100例女性被确诊为卵巢癌,约22,500例女性死于卵巢癌。
1940年, David Smithers首先发现乳腺癌存在家族遗传现象;1990年, M.Cking发现了一种直接与遗传性乳腺癌相关的基因,并将其命名为乳腺癌1号基因,简称BRCA1;1994年有研究者又发现了另外一个与乳腺癌有关的基因BRCA2。BRCA是重要的抑癌基因,由BRCA1和BRCA2编码的蛋白质的作用涉及DNA损伤修复、基因转录调控和细胞周期调节等多种生命活动。研究数据表明,BRCA1和BRCA2基因突变不仅使女性乳腺癌发病风险增高5倍,卵巢癌风险增高10至30倍,而且也增加了前列腺癌、胰腺癌、黑色素瘤等肿瘤的发病风险,因此BRCA1和BRCA2基因是评估乳腺癌等肿瘤发病风险和制定个体化治疗方案的重要生物标志物,检测BRCA基因有着重要的临床意义。NCCN、CSCO、美国乳腺外科协会及中国抗癌协会等均明确推荐BRCA基因检测,检测结果可在药物选择、手术方案、高危人群筛查等方面辅助临床决策。
聚腺苷二磷酸核糖聚合酶(PARP)是一种DNA修复酶,在DNA修复通路中起关键作用,PARP抑制剂可阻断肿瘤细胞修复损伤DNA的能力,有研究发现携带BRCA突变的肿瘤细胞对PARP抑制剂较为敏感。PARP抑制剂的出现开启了卵巢癌、乳腺癌等女性肿瘤靶向治疗的新时代,其中,奥拉帕利已在国内获批用于卵巢癌患者的治疗。2018年ESMO大会上公布的SOLO1临床研究数据显示,奥拉帕利可显著延长BRCA突变阳性卵巢癌患者的无疾病进展生存期。根据2017年专业权威期刊NEJM报道的临床研究结果,奥拉帕利可显著延长BRCA突变阳性、HER2阴性乳腺癌患者的无疾病进展生存期。这为传统方式难以治疗的部分乳腺癌患者提供了新的选择。
公司基于自主专利NGS技术研发的BRCA基因检测试剂“维汝健™”——人类BRCA1基因和BRCA2基因突变检测试剂盒(可逆末端终止测序法),覆盖了存在BRCA基因突变位点的编码区和非编码区,包括BRCA1和BRCA2基因编码区、外显子内含子连接区、UTR区、启动子区等。经国家药品监督管理局(NMPA)批准,该产品可用于PARP抑制剂奥拉帕利片的相关用药指导。
4.4. 海外市场:全球化战略布局
对于海外市场,公司通过积极参与药企原研药的临床试验,进而争取作为捆绑的伴随诊断试剂获批的方式进行拓展。
2010年11月,公司与阿斯利康(AstraZeneca)达成靶向药物个体化医疗基因突变检测战略合作协议,Super-ARMS EGFR成为我国首个以伴随诊断标准审评的基因检测产品。2017年3月,阿斯利康公司的三代靶向药物泰瑞莎(奥希替尼,AZ9291)在中国上市,作用于一代或者二代靶向药物发生耐药的特定基因突变(T790M),具有高度的特定基因突变选择性。而公司的Super-ARMS技术,检测EGFR的E19Del、L858R和T790M突变的分析灵敏度达0.2%、特异性达100%,适用于血液EGFR突变检测。
2016年10月,百年制药公司默克与公司展开合作,致力于结直肠癌检测中新型RAS液体活检在全球的开发和推广,以及肿瘤组织RAS检测推广,为结直肠癌患者提供及时的个体化诊疗方案。新型RAS液体活检采用的是公司ADx-SuperARMS技术。

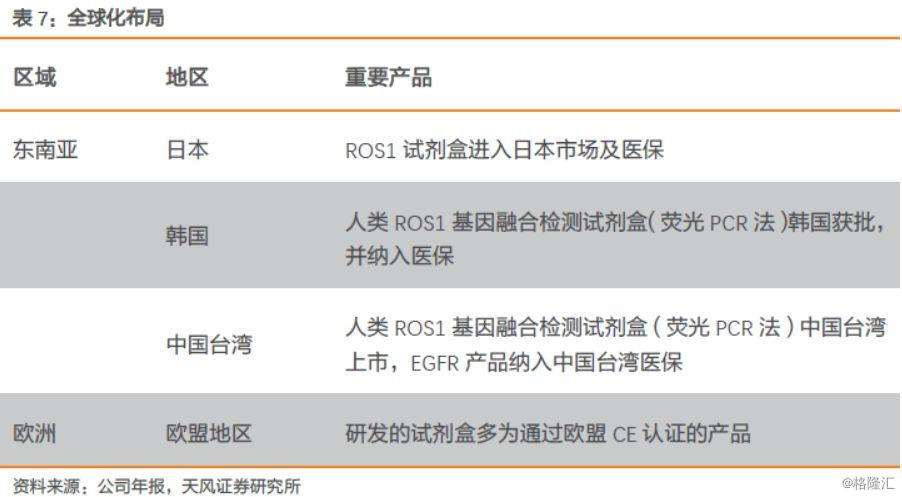
2017年6月23日,公司的ROS1基因融合检测试剂盒,帮助辉瑞公司靶向药物克唑替尼用于一线治疗ROS1融合基因阳性患者的亚太临床研究取得成功,并获得日本、韩国、中国台湾医疗器械注册证,且进入日本、韩国医保,是国内企业首个在海外获批的伴随诊断试剂。ROS1基因融合检测试剂盒采用RT-PCR技术,以NSCLC样本RNA为检测对象,对NSCLC中存在的多种ROS1基因融合类型进行检测,从而辅助临床选择出可受益于克唑替尼的NSCLC患者。
2019年6月24日,公司自主研发的“艾惠健”和“维惠健”将成为礼来制药子公司LOXO ONCOLOGY跨癌种RET抑制剂“LOXO-292”在亚洲范围内的药物临床实验伴随诊断试剂。有利于进一步增强公司在亚洲市场的竞争力,对公司未来的发展将产生积极影响。
5. 市场关注问题
5.1. 伴随诊断空间有限?
未来市场增长来源于三方面:1)传统癌种(肺癌、结直肠癌、乳腺癌、卵巢癌、黑色素瘤)检测渗透率、人均检测次数、人均客单价(使用多基因产品)持续提升;2)新靶向药的上市,其他癌症成为潜在伴随诊断使用群体;3)艾德布局全球化市场,市场空间拓展至全球。
目前海外伴随诊断(PCR/NGS)主要的应用是五个癌种,分别为肺癌、结直肠癌、乳腺癌、卵巢癌、黑色素瘤,根据上文的测算,这五个癌种每年新发总患者数为133.1万人,假设平均渗透率为30%,人均检测1.5次,单价为1500-2000元,市场规模为9-12亿元。我们认为伴随诊断市场处于快速发展阶段,从宏观层面,全球市场增速仍然有20%的增速增长,国内市场能够达到25-30%,增长动力强劲。
在传统癌种市场,渗透率、人均检测次数、人均客单价(使用多基因产品)都仍有提升空间,随着更多的靶向药上市,其他约3/4的癌症患者也将成为潜在的伴随诊断使用群体,市场空间还将扩大。对于艾德而言,其市场触角不局限于国内市场,艾德已经开始走向全球化市场,产品推广至东南亚、欧盟等50多个国家和地区,2018年国外收入占比10.45%,成为少数国内布局全球化的医疗器械公司。
5.2. ARMS-PCR技术壁垒如何?
艾德通过自主研发的ARMS-PCR技术,开发出一系列的突变检测试剂盒,公司ADx-ARMS是目前国际上肿瘤精准医疗分子诊断领域最先进的技术之一,可用于多重基因高通量检测,已获我国发明专利。
这项技术的壁垒是专利和时间的积累。基于ADx-ARMS平台,公司申请了一系列专利,包括各类型基因的引物设计,由于不同基因的序列及结构的不同,对应的引物、探针需要单独设计。当多个基因或突变同时检测的时候,各个引物之间容易相互影响,容易产生引物二聚体、荧光干扰、竞争性扩增等问题,影像到扩增效果,同时还需要考虑循环参数、反应体积、反应体系等环节,这个过程需要长时间的经验积累。
目前能实现多个基因同时进行PCR检测的试剂盒很少,主要是艾德生物生产的,技术积淀深厚。基于此技术,艾德和海内外知名药厂紧密合作,依托院内渠道资源,共同推进临床,与药物同步上市,先发优势明显,持续保持竞争力。
5.3. 检测项目纳入医保后的降价情况?
IVD检测收费目录价格调整较为温和,企业通过产品迭代,保持毛利率水平。
器械粗略的可以分为检验性器械(IVD、影像等)和治疗性器械(骨科、支架、起搏器等)。对于IVD而言,由于各家检测原理、产品性能、技术路径等不尽相同,同时各家企业在做产品设计时也有考虑到规避专利的问题,因此各家IVD仪器和试剂内在本质是不同的,同时检验与治疗不同,没有具体标准判断检验结果是否准确,因此难以用统一的标准来做衡量。IVD仪器和试剂进院多以市场化竞争为主。
医保对于药品基本是直接报销,而IVD是以医疗服务来收费,医保支付的是医疗服务价格,并非直接支付采购价,仪器和试剂是医院的成本项,提供检验服务,医疗服务是临床医生价值的体现,属于合理收入,是国家政策鼓励的方向。

从长趋势来看,传统项目医疗检验项目收费是在逐步下降的,但是我们认为这种调价是温和的,并非恶行竞争,剧烈的价格调整对于医院是不利的,包括现有仪器折旧、试剂溯源、检测流程质控等问题。传统项目收费温和下降,对于企业而言,则会通过联合检测、新项目、新仪器试剂等方式,维持公司平均出厂价格,维持毛利率水平,因此收费标准降价对于IVD,对于艾德影响有限,艾德历年以来毛利率维持稳定。

5.4. 院外样本对院内样本的冲击有多大?
检测样本外流情况并不明显,我们判断2018年院外样本检测量仅占院内样本检测量的10-20%,未来院内检测才是主流。
2014年3月,原国家卫生计生委医政医管局发布《关于开展高通量基因测序技术临床应用试点单位申报工作的通知》,对于符合要求的医疗机构,开放肿瘤基因诊断试点,其中一个重要的考核指标是要求实验室需要参加室间质量评价工作。室间质量评价(EQA,external quality assessment),是利用实验室间的样本结果比对来确定实验室能力的活动。根据今年发布的《2019年国际肿瘤游离DNA(ctDNA)基因突变检测室间质量评价》结果,我国共有来自19个省(市、自治区)的146个实验室参加,最终有126家实验室回报了结果,核酸提取合格125家,满分53家,满分通过率42.4%。
通过肿瘤基因诊断试点的实验室构成了目前庞大的院外市场,从参加室间质量评价的机构数上可见一斑,院外实验室的检测项目上不受限制,因此市场上数百个基因数的检测产品层出不穷,吸引医生和患者参加,同时收费上各有高低,整体而言比院内检测要更高。
我们测算2018年院外样本检测量仅占院内样本检测量的10-20%,实际上院外实验室并未对院内检测量带来明显冲击,同时院外实验室质量控制不规范,从上文的满分通过率可以看出,未来合规、高质量、高性价比的肿瘤基因检测将成为主流,院外检测会有向院内回流的趋势,因此我们认为院内检测才是主流。
5.5. NGS对现有市场的冲击?
随着靶向用药陆续上市,需要检测的靶点相应增多,PCR检测通量限制成为重要问题之一,同时火热的免疫治疗提出肿瘤突变负荷TMB和微卫星不稳定性MSI的需求,NGS技术应用成为大家关注的话题。
我们认为NGS是未来的一个重要趋势,但是就目前行业发展阶段而言,NGS的广泛应用仍然遇到种种瓶颈,PCR依然是伴随诊断领域重要的检测手段,基于以下分析:
5.5.1. 就目前靶点而言,PCR检测能够满足要求
以靶向药最为丰富的肺癌为例,治疗模式已经延伸至三线治疗,全球潜在的四线治疗也在如火如荼的研发当中。面对众多的靶向用药,艾德目前推出的艾惠健能够满足肺癌一线核心驱动基因的快速检测需求。
5.5.2. 免疫治疗伴随诊断分子标记物尚未明确,TMB并不能有效预测治疗效果
肿瘤突变负荷(Tumor Mutation Burden,TMB)是指肿瘤细胞基因组中每Mb序列中存在体细胞突变的个数,体细胞突变个数越多,产生的新抗原越多,就能激活更多T细胞产生更强大的免疫反应,免疫治疗药物效果就更好。2018年美国癌症研究协会年会(AACR)上发布的CheckMate 568和CheckMate 227均证实了TMB与免疫治疗效果的相关性,NCCN指南中将TMB列入到了免疫疗法的推荐检测方法之中。TMB的检测需要大量基因组数据做分析,因此NGS成为了TMB检测的最佳方式。
然而后续的一些研究数据显示,TMB与免疫治疗的疗效之间关联性并不强。根据最新第20届世界肺癌大会(WCLC 2019)的数据,关于默沙东(MSD)的两项临床试验KEYNOTE 189与KEYNOTE 021里,重磅免疫疗法Keytruda(pembrolizumab)的疗效与肿瘤突变负担(TMB)没有显著关联。在原有NCCN指南中,NCCN也明确指出:“TMB是一个还在研究之中的生物标志物,它可能有助于选择使用免疫疗法的患者。而对于如何测量TMB水平高低,目前还没有共识。”因此,我们认为由TMB带来NGS检测需求的驱动力不强。
艾德正在开发新型免疫治疗标记物。基于丰富的院内渠道和样本数据资源,艾德正在推动基于人工智能和医学大数据的肿瘤免疫治疗检测产品及软件研究项目(公司2019年中报披露)。这是艾德独有的优势,通过大量积累的临床数据,领先于市场开发出临床所需的伴随诊断试剂盒,获得医院广泛认可,进而获得更多更新的临床数据,实现良好的循环,构建公司核心竞争力。
5.5.3. NGS收费标准混乱,院内收费较低,难以覆盖成本
由于肿瘤相关NGS试剂盒去年才陆续获批上市,各地还处于申请收费目录的过程。由于NGS在实验室建设成本、仪器试剂成本、人员成本等方面均比PCR更高,我们认为NGS的终端定价需高于PCR才符合市场规律。参考中山大学肿瘤防治中心分子诊断科曾经披露的肿瘤高通量测序基因检测的通知,对于基因突变高通量检测,一次性检测65个药靶基因、107个其他经典原癌/抑癌基因及包括12条信号通路的肿瘤高度相关基因,收费定价为8千余元/人份,收费较高。
5.5.4. NGS检测上游单一厂商依赖性高,产业链利润集中于上游
全球二代测序NGS上游测序仪领域市场份额集中,Illumina和Thermo Fisher(收购了Life Technologies)占据大部分的市场份额,其中Illumina是绝对的龙头,国内大部分NGS试剂盒上游供应商均来源于Illumina,Illumina在产业链条中话语权强,占据利润空间大,掌控产业核心要素,因此从直接利润的角度,国内NGS厂商在未来开拓市场时容易遇到瓶颈。艾德定位于伴随诊断整体解决方案商,早期通过PCR布局市场,获得龙头的市场地位,同时结合多种分子诊断方式,满足临床需求,NGS仅作为艾德的一项工具,艾德公司的整体风险较低。
我们认为未来发展趋势上面来看,PCR并不会被NGS所替代,二者作为临床医学检测重要手段,将会共同存在于市场。
5.6. BRCA检测国内市场有多大?
2019年初,艾德生物的人类BRCA1基因和BRCA2基因突变检测试剂盒(维汝健)正式获NMPA批准上市。这是艾德生物第二个获得NMPA批准的NGS产品,同时也开创了BRCA基因NGS检测产品获批的先例。维汝健可用于奥拉帕利Lynparza的相关用药指导。目前仅有艾德的BRCA检测试剂盒获批上市,后面竞争者是华大基因,仍处于绿色审评通道当中。
奥拉帕利Lynparza在超过60个国家获批用于治疗卵巢癌,2018年则在美国和日本获批治疗乳腺癌。参考国内乳腺癌和卵巢癌每年发病人数合计为32.4万人,我们测算国内现有BRCA市场约为1.7-2.3亿元,假设艾德市占率为50%,在成熟阶段将每年为艾德贡献约1亿销售额。

5.7. 艾德产品梯队如何?
艾德持续与国际知名药厂合作,在国内共同推进药物临床,积累国内临床数据,有望作为其药物的伴随诊断试剂盒同步上市,通过先发优势占领市场,目前国内这种趋势愈发明显。
2019年6月,公司发布公告称与LOXO ONCOLOGY, INC.(礼来制药子公司)达成靶向药物临床研究合作,艾德将成为LOXO ONCOLOGY跨癌种RET抑制剂LOXO-292亚洲(包括中国大陆、日本、中国台湾在内)药物临床实验的伴随诊断试剂,并将按日本LC-SCRUM(日本国家癌症中心肺癌项目)的高标准构建服务亚洲患者的临床基因检测平台。根据最新消息,9月26日,CDE网站显示,礼来RET抑制剂LOXO-292在国内申请临床,这是该药物首次在国内申请临床试验。
LOXO-292是一款高度特异性口服RET抑制剂,用于治疗携带RET基因融合或激活性突变的肿瘤类型。RET基因融合在NSCLC患者中的发生率约为1%~2%,在甲状腺乳头状癌(占所有甲状腺癌的85%左右)中的发生率为10%~20%,在甲状腺髓样癌中的发生率为60%左右,同时在其他癌种上面也有发现RET基因融合。未来随着药物上市并扩大使用,将成为艾德下一重要贡献的产品。
6. 盈利预测及估值分析
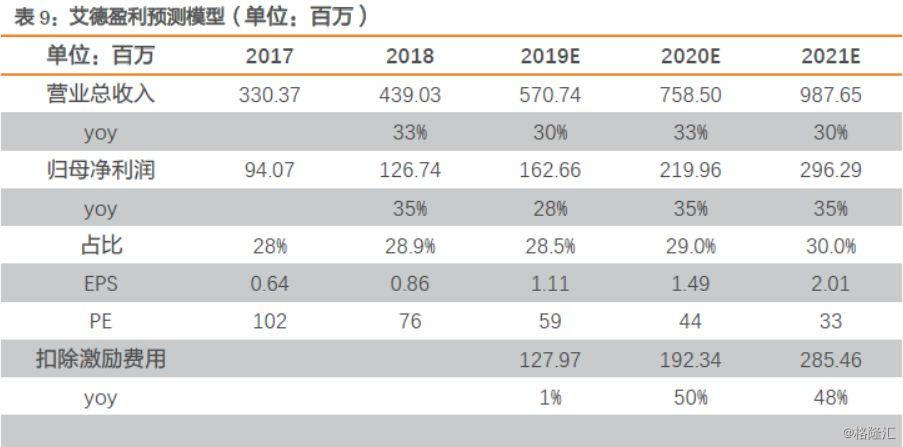
根据上文测算,假设伴随诊断行业增速为25%以上,以及公司产线历史增速情况,我们预计2019-2021年公司营收为5.71/7.59/9.88亿元,归母净利润为1.63/2.20/2.96亿元,对应EPS为1.11/1.49/2.01元。
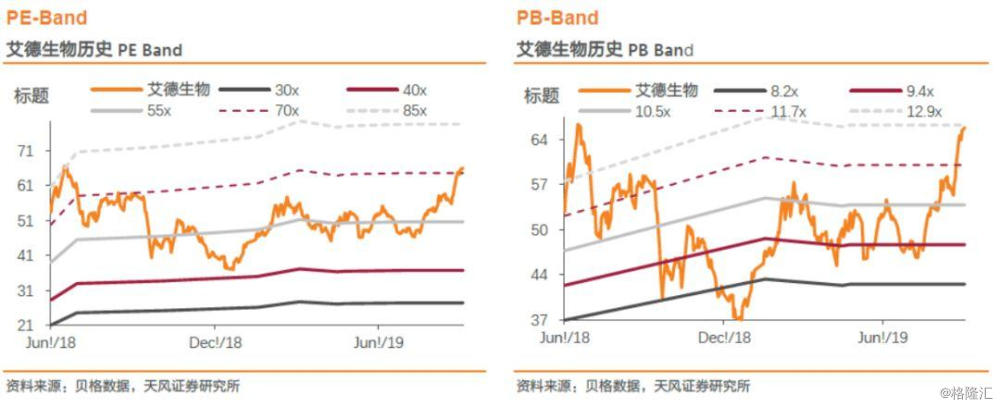
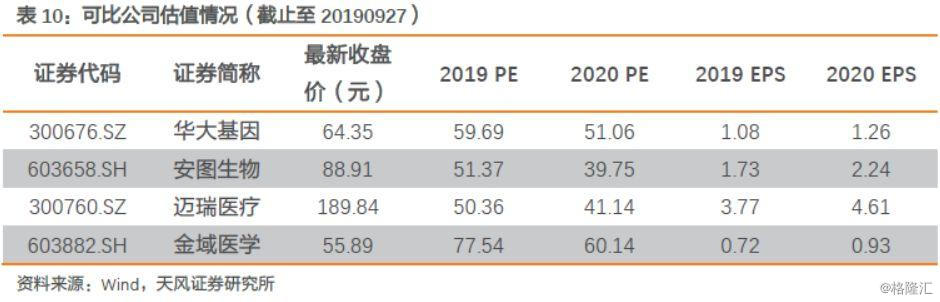
参考可比公司估值情况,艾德和华大均属于分子诊断领域,艾德所处肿瘤检测高景气度,产品丰富,公司业绩增速更高,给予一定估值溢价,2020年给予艾德生物53X估值,对应目标价78.97元,上调至“买入”评级。

7. 风险提示
收费目录降价风险:国家医保局成立后,医疗领域降价成为大趋势,收费目录的调整会影响到上游供应商的价格,对公司业绩带来负面影响
BRCA推广不及预期:BRCA产品今年仍处于推广期,终端药物使用情况和医生患者检测意识,将会影响到BRCA检测试剂盒的放量情况
loxo临床推进不及预期:loxo药物目前国内处于临床当中,存在一定的不确定性
报告来源:天风证券股份有限公司
报告发布时间: 2019年10月01日
本资料为格隆汇经天风证券股份有限公司授权发布,未经天风证券股份有限公司事先书面许可,任何人不得以任何方式或方法修改、翻版、分发、转载、复制、发表、许可或仿制本资料内容。
免责声明:市场有风险,投资需谨慎。本资料内容和意见仅供参考,不构成对任何人的投资建议(专家、嘉宾或其他天风证券股份有限公司以外的人士的演讲、交流或会议纪要等仅代表其本人或其所在机构之观点),亦不构成任何保证,接收人不应单纯依靠本资料的信息而取代自身的独立判断,应自主做出投资决策并自行承担风险。根据《证券期货投资者适当性管理办法》,若您并非专业投资者,为保证服务质量、控制投资风险,请勿订阅本资料中的信息,本资料难以设置访问权限,若给您造成不便,还请见谅。在任何情况下,作者及作者所在团队、天风证券股份有限公司不对任何人因使用本资料中的任何内容所引致的任何损失负任何责任。本资料授权发布旨在沟通研究信息,交流研究经验,本平台不是天风证券股份有限公司研究报告的发布平台,所发布观点不代表天风证券股份有限公司观点。任何完整的研究观点应以天风证券股份有限公司正式发布的报告为准。本资料内容仅反映作者于发出完整报告当日或发布本资料内容当日的判断,可随时更改且不予通告。本资料内容不构成对具体证券在具体价位、具体时点、具体市场表现的判断或投资建议,不能够等同于指导具体投资的操作性意见。
 下载格隆汇APP
下载格隆汇APP
 下载诊股宝App
下载诊股宝App
 下载汇路演APP
下载汇路演APP

 社区
社区
 会员
会员



