5月31日至6月1日,国际人用药品注册技术协调会(ICH)2017年第一次会议在加拿大蒙特利尔召开。会议通过了中国国家食品药品监督管理总局的申请,总局成为国际人用药品注册技术协调会正式成员。
作为回应,6月19日,国家食品药品监督总局(CFDA)举行国际人用药品注册技术协调会(ICH)新闻通气会,并在会上表示,正式确认总局加入ICH,成为其全球第8个监管机构成员。
从明面上看,加入ICH意味着中国在药品研发和注册国际化道路上迈出了历史性一步,CFDA在国际药品研发和注册技术要求领域有了发言权和参与决策权,中国医药产业面临挑战的同时也获得巨大的发展机遇,加入ICH更是CFDA药品监管水平和能力获得国际认可的标志。
但锣鼓喧天的喧闹中,总会有人后背发凉。
先来简单解释一下“ICH”,ICH的全称是The International Council for Harmonisation,CFDA对其称为“国际人用药品注册技术协调会”,于1990年由美国、欧共体和日本三方药品监管部门和行业协会共同发起成立。
ICH的基本宗旨是在药品注册技术领域协调和建立关于药品安全、有效和质量的国际技术标准和规范,作为监管机构批准药品上市的基础,从而减少药品研发和上市成本,推动安全有效的创新药品早日为患者健康服务。经过二十多年的发展,ICH发布的技术指南已经为全球主要国家药品监管机构接受和转化,成为药品注册领域的核心国际规则制订机制。
2012年,ICH启动改革,并最终于2015年12月由一个封闭的国际会议机制,转变成为在瑞士民法下注册的技术性非政府国际组织,名称改为“国际药品技术要求协调组织”,而简称不变。改革后的ICH不是以国家为单位,满足一定标准的有资质的组织都可以申请ICH的成员和观察员身份。
众所周知,药品是一种特殊商品,每个国家为了用药安全与产业利益均会对药品实施严厉的监管,对药品的研制、开发、生产、销售、进品等进行审批,形成了药品注册制度。
但是不同国家对药品注册要求各不相同,这不仅不利于病人在药品的安全性、有效性和质量方面得到科学的保证及国际技术和贸易交流,同时也造成制药工业和科研、生产部门人力、物力的浪费。
于是才有了ICH组织的诞生,用句简单话来描述,ICH最主要的目标就是通过国际协调,建立统一成员国之间人用药的药品注册标准与要求。同时,改革新药研发技术的标准,节约药品开发周期和成本,提高新药研发、注册、上市效率。
打破国别保护,提高新药注册上市效率本是一件利国利民的好事,但我们的产业格局准备好了么?
一、国际新药入华之殇
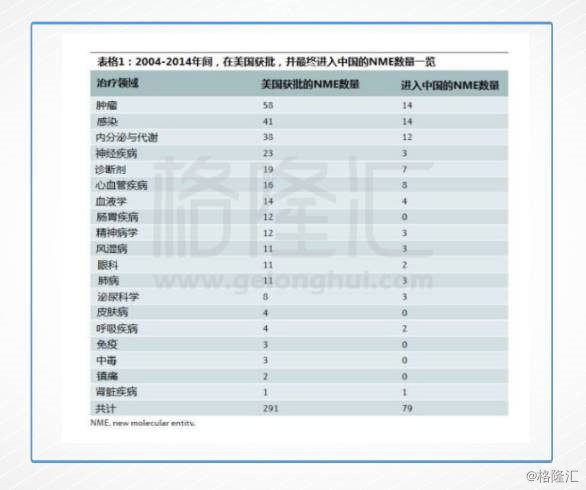
毫无疑问,目前美国、欧洲、日本集中了最先进的制药技术和最前沿的重磅药物,但由于国内进口药物注册制度的审批要求,这些产品进入国内市场存在着严重的滞后,在2016年的《Nature Reviews Drug Discovery》期刊上,复旦大学的邵黎明教授等学者刊发了一篇深度报道,分析了创新药进入中国的滞后情况。
通过比较2004年-2014年美国FDA官网、CFDA官网以及业内其他数据库的信息,研究人员发现在美国获批的291个新药(NME)中,只有79个在中国获批,比例不到30%。
即便这些新药最终能够进入中国,在获批前也需要经历漫长的审批过程,譬如用来治疗肾炎患者甲亢症状的西那卡塞(cinacalcet)早在2004年就得到了美国FDA的批准,而它在2014年才在中国获批,中间相隔长达10年。
此外,像治疗非小细胞肺癌的厄洛替尼(erlotinib)、首个抗肿瘤血管生成药物贝伐珠单抗(bevacizumab)、治疗乳腺癌的拉帕替尼(lapatinib)与治疗白血病的达沙替尼(dasatinib)等新药,进入中国的时间都要滞后超过5年。
究其原因,是繁复的审批流程造成的:进口药物的临床试验申报获批平均需要11个月,新药申请则需额外的20个月,更何况新药临床试验平均也需要进行28个月。换句话说,一款进口药物想要在国内上市,光是走完这个流程就需要近5年。
无法进行同步临床,同步上市基本就是一个死结。
在这样充裕的时间窗口,自然造就了国内仿制企业生存的机会与空间。当然,和世界上所有国家一样,药品注册制度的设计总体需要衡量产业发展、药品定价、医保支付等等相关因素。
但严峻的现实是中国的患者等不起。在庞大的人口基数面前,中国罹患各种疾病的患者数量堪称巨大。在漫长的等待中,每分每秒都有患者抱憾辞世。
二、ICH双刃之剑
ICH的宗旨是协调不同国家间药品质量、安全性和有效性的技术规范,推动药品注册要求的一致性和科学性。而ICH使命是获得更广泛的国际合作以确保安全、有效、高质量的药品研发和更有效率的注册。
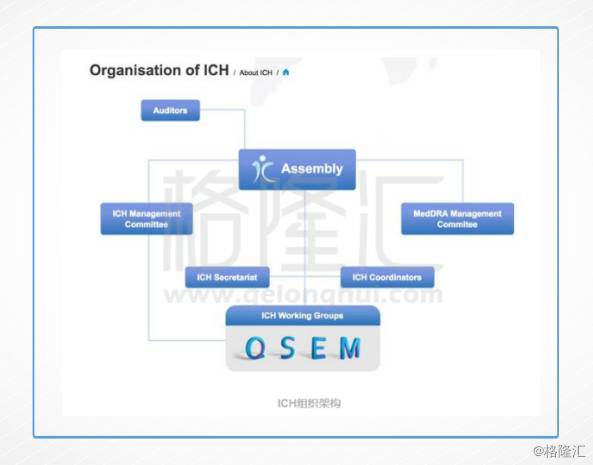
所以,非常明显的一点,就是ICH纳入中国作为正式成员,也就意味着ICH承认中国政府的药物监管水平,并真正融入到国际药品监管体系中。但另一面,意味着中国药物监管政策的制定也必须按照ICH的指导原则,遵循ICH的标准。
上图QSEM代表:“Q”部分是质量指导原则,“S”部分是安全指导原则,“E”部分是药效指导原则,“M”部分是多学科指导原则。
在加入ICH之前,我国药监制定的药物政策法规很大程度上是遵照WHO(世界卫生组织)的标准。而WHO被认为是全球最低标准,ICH则是发达国家的最低标准。
所以,我们加入ICH,等于在药物注册监管层面拿到了一张精英俱乐部的门票,但这张门票对整个产业将带来多大的提升,还要靠医药产业自身的基础与实力来决定。
当年创办ICH的初衷,就是为了让多国混乱各自成一体的药物监管系统标准化,让多国都遵守同样的方法和审批程序进行审批工作,其目的就是为了让ICH成员国的产品可以尽快相互认证。
所以,ICH的核心是发达国家制定标准让其他国家接受,所以业内有“一流国家制定标准,二流国家生产和销售产品,三流国家提供原料”的说法。但纵观世界经济产业格局,所有标准之争的背后,一定是利益之争。
首当其冲的是国际创新药将在中国同步上市,关于这一点,在正式加入ICH之前,CFDA其实已经做了监管政策的准备。早在多年前,国家食药监总局就组织翻译了ICH的指导原则,并运用了其中很多原则,包括FDA(美国食品药品监督管理局)的一些指导原则和内容,都作为参考进行使用。
近年国家食药监总局组织制订发布的许多技术指导原则在起草过程中不同程度地参考了ICH相关指导原则,在内容和技术要求上与ICH技术指导原则非常接近。
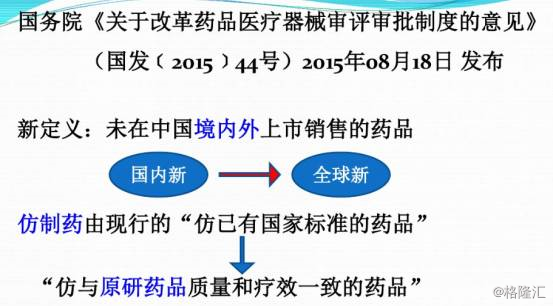
一个关键的时点是2015年8月,国务院发布了《关于药品医疗器械审评审批制度的意见》,这被业界视为里程碑式的一次改革。根据此项指南,中国“允许境外未上市新药经批准后在境内同步开展临床试验。鼓励国内临床试验机构参与国际多中心临床试验,符合要求的试验数据可在注册申请中使用。”此外,我国也将“对创新药实行特殊审评审批制度。加快审评审批防治艾滋病、恶性肿瘤、重大传染病、罕见病等疾病的创新药”。
最后,CFDA也在招聘更多的审评员,以期加速整个流程。这些修改意味着整个新药审评和批准的流程将大大简化,也更为透明与高效。
与此同时,中国新药批准的门槛得到了进一步提高——目前,申请者需要自行负责核实临床数据的准确性。换句话说,新药获批所需要的临床数据变得更为严谨。
回过头看,这些政策的推出,都在为中国加入ICH做积极的准备,本质上,拿到门票的代价,就是更加全面的开放市场。
2017年3月,作为具体落地措施,CFDA出台了《总局公开征求《国家食品药品监督管理总局关于调整进口药品注册管理有关事项的决定(征求意见稿)》意见的通知》,根据通知显示,CFDA对进口药品注册管理有关事项将作如下调整:
一、在中国进行国际多中心药物临床试验的,取消临床试验用药物应当已在境外注册或者已进入II期或者III期临床试验的要求,疫苗类药物除外。
二、对于在中国进行的国际多中心药物临床试验,完成国际多中心药物临床试验后,可以直接提出药品上市注册申请;提出上市注册申请时,应当执行《药品注册管理办法》及相关文件的要求。
三、对于申请进口的化学药品新药以及治疗用生物制品创新药,取消应当获得境外制药厂商所在生产国家或者地区的上市许可的要求。
四、对于本决定发布前已受理的,以国际多中心临床试验数据提出免做进口临床试验的注册申请,符合要求的,可以批准进口。
从三报三批到两报两批,缩短简化的新药上市程序无疑将节省药企大量成本,并争取更早进入市场的时间。CFDA允许外企新药在还没取得国外上市许可的情况下,就可以在国内上市,也引起市场热论。
毫无疑问,这些举措的推出,对国际创新药在中国同步上市有着重大影响,缩短国际创新药物在中国的上市时间,意味着老百姓可以有机会享受到最新的国际医疗技术与服务。对于很多已被判为绝症的患者而言,又开启了一道希望之窗。
但在产业层面,最焦虑的还应该是仿制药企业,由于时间窗口急剧缩短,仿制药企业的生存势必受到挤压。同时,国外仿制药企进入中国注册的门槛也将降低,仿制药企业将面临巨大的转型压力。
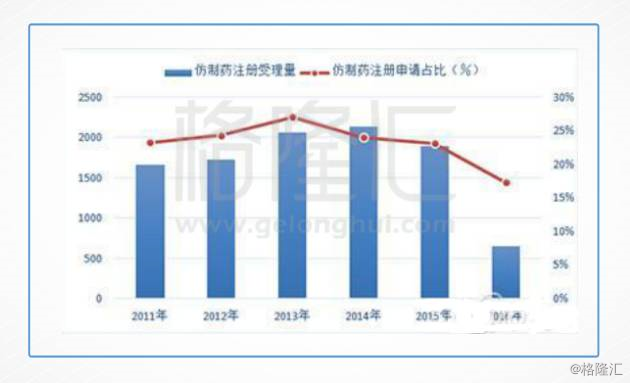
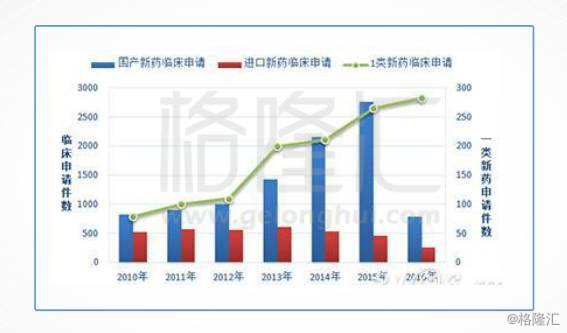
翻翻数据,从2016年的中国新药注册申报数量充分体现着这种焦虑。
随着2016年化学药品注册分类改革和仿制药一致性评价相继落地,2016年国家药品审评中心共承办药品注册申请3778件,这一数字不到上一年度受理量的一半,创下了近10年来的新低。
特别需要引起注意的是仿制药注册申请量开始下降。2016年度CDE受理的仿制药注册申请量为649件,仅及上一年度受理量的1/3,并且其中超过90%都是化学药品注册分类改革实施前已经申报的存量,2016年当年申报的仿制药申请不到100件,显示当前我国仿制药的研发进入了深度调整期。
三、以创新的名义仿制,享受新药高利润的仿制药时代逐渐远去
考虑到历史和家底,准确的说,我国化学医药工业的起步,就是靠仿制起家的。这是第三世界国家的医药工业起步发展的标准路径。所以,多年下来塑造的产业格局并不容易被打破,每个国家在细分行业里赖以生存和发展的机制,一定多方利益长期博弈妥协最后稳定下来的。
这样看,你就可以理解为什么有人说抗战用了8年而打败国民党只用了3年,但打败药价用了18年还不知道最终结果。
仿制药其实起源于美国,1984年美国约有150种常用药专利到期,大药商认为无利可图,不愿意继续开发,为此美国出台The Waxman-Hatch法案,新厂家只需向FDA证明自己的产品与原药生物活性相当即可仿制,仿制药概念由此出现,后被欧洲、日本等采用。
简单地说,仿制药就是药品生产厂家等着国际大公司某一药品的专利期过去,再对药物进行仿制和销售。和专利药相比,仿制药在剂量、安全性、效力、作用、质量以及适应症上完全相同,但均价只有专利药的20%—40%,个别品种甚至相差10倍以上。
可以看出,要提高医疗质量,又没有足够的财力支付昂贵的专利药,那么仿制药是最好的选择,而长期以来,我们制定的所谓创新药物划分,基本都是基于仿制药的仿制速度不同来区分而已。即便是一类新药里属于自己研发的全新化合物也是屈指可数。
所以,时间窗口就变得尤为重要。“抢仿”一词由此而来。
考虑到医药工业、医保承付能力以及国家支持创新的态度,大量仿制药企业多年来已经习惯了享受政策红利的惠顾,宁愿把精力财力投入在药品定价环节,也不愿去真正搞创新,这里从发改委历任数位司长的出事频率就可以看出这股洪流是多么强大,但另一方面,即便一类新药获批,还要耗尽时间与精力去打通医保目录环节,这也让企业也深感负担沉重,风险巨大。
但是,时代的洪流已经在推动产业格局的深刻改变,从监管层面来说,药品注册审评制度改革、仿制药一致性评价、药品上市许可持有人制度等政策的推进,已经在明显挤压仿制药企业的红利路径,ICH仅仅是水到渠成的必然结果。
所以,市场将会迎来真正的创新时代,尽管,这个时代的前半程一定会倍加艰难,从下面欧盟委员会最新公布的2015-2016财年,来自制药/生物技术等领域的全球2500家公司的研发投入数据就可以看出:
1、2015/16财年全球制药/生物技术R&D研发投入排行榜
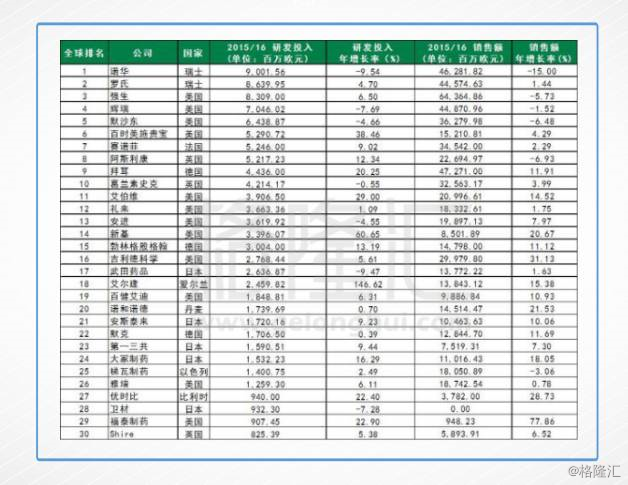
2、2015/16财年全球药企R&D研发投入世界排名Top30
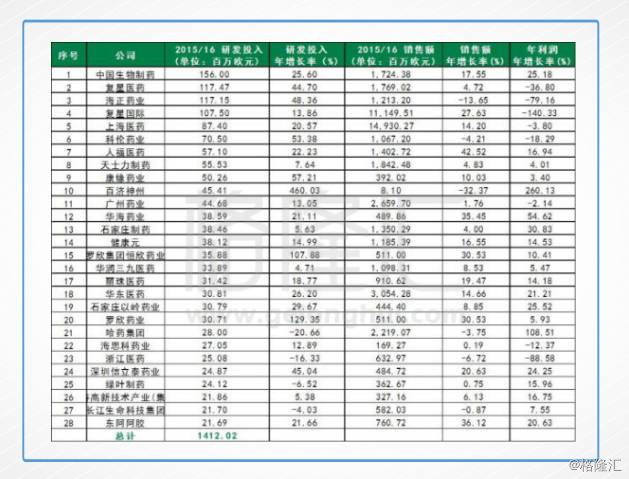
3、2015/16财年中国药企研发R&D投入情况
基于统计口径区别,再扒一下最新的国内A股上市企业数据做对比:
可惜的是,扒完之后连放的欲望都没有,2016年全年研发开支第一的化药一哥恒瑞仅11.84亿人民币,其他的就更不用说了...
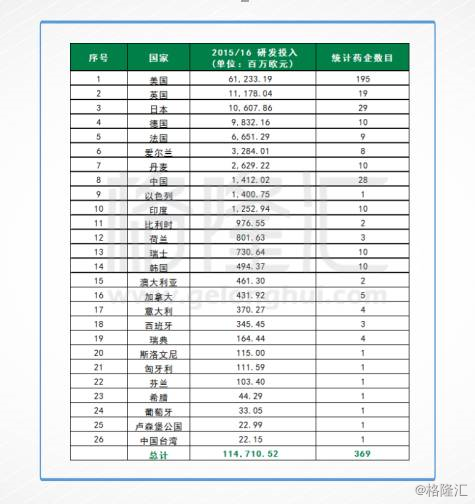
对比一下欧盟的数据,相对于诺华和罗氏动辄每年八、九十亿欧元的投入,当中的差距不是短期可以赶上的。按照欧盟的样本数据,2015-2016财年,中国的研发投入增长最快,但研发金额仅占到了全球研发投入的1%,远低于美国的46%和欧盟的28%。
所以,ICH仅仅开启了一扇门,接下来对于创新药的定义以及相关的医疗配套政策也将随之调整(2016年,随着化学药品注册分类改革的实施,原3类新药被划入仿制药管理),而随着竞争格局的改变,Me-too 创新药面临和国际竞争对手直接头对头 PK,药物研发、临床试验难度和费用均将大幅提高,前面的路任重而道远。
四、仿制药一致性评审导致产业集中度大幅提高,普药不普
2012年,国家食品药品监督管理局发布《仿制药质量一致性评价工作方案(征求意见稿)》向社会公开征求意见。方案是根据2012年2月发布的《国家药品安全“十二五”规划》的相关要求,拟用5-10年时间对2007年修订版《药品注册管理办法》实施前的仿制药,分期分批与被仿制药进行质量一致性评价,其中纳入国家基本药物目录、临床常用的仿制药在2015年前完成。
出台仿制药一致性评审的宏观背景是整个医药行业产能过剩引发低价恶性竞争,进一步威胁到药品供应以及药品质量的必然监管举措。当时我国批准上市的药品1.6万种,药品批准文号18.7万个,其中化学药品0.7万种,批准文号12.1万,其中绝大多数为仿制药;仅方案中计划未来4年完成一致性评价工作的570个化药品种,就涉及3.3万个批准文号、2400余家药品生产企业。可见国内仿制药重复生产和产能过剩的严重程度。
同时,早期批准的仿制药医药学研究基础相对薄弱,部分仿制药质量与被仿制药之间差距较大,但是此前官方并不承认质量差异,最终造成了大量生产企业竞标同一品规的药品,而招标部门只能将价格作为主要指标,导致了目前招标中普遍出现的“唯低价是取”。
但仿制药一致性评价不仅仅是中国特色。美国在1971年启动生物等效性评价,历时10年、淘汰了6000种药品;1975年,英国对1968年药品法出台之前上市、且没有经受任何独立的药品安全性和有效性资料审查的36000种药品,包括4000种专有处方药,进行了评价审查;1997年日本启动“药品品质再评价工程”,通过全面而严格的体外溶出度试验进行评估,至今完成了约730个品种。
根据最新的规划,将有289个品种在2018年底要完成仿制药一致性评价。这289个品种基本涵盖了当期主流的普药品种。当然,其他的产品还要在这之后通过仿制药一致性评价,只是时间有所延迟而已。
作为惩罚,至2018年,国家基本药物目录中化学药品仿制药口服固体制剂品种未予通过评价的,不得上市。其他品种,自首家医药品种通过评价后,其他同品种在3年内未通过评价的,不得上市;药品批准文号有效期届满时仍未通过评价的,予以注销;同一品种达到3家以上通过仿制药一致性评价的,在招标采购、医保报销等方面不再选用未通过评价的品种。
由此可以看出,本质上,仿制药一致性评价就是仿制药品的供给侧改革,为了推动有国际化眼光和能力的企业将通过欧美批准上市的优质产品流回国内,审评中心还开辟的绿色通道。
2016年5月26日国家食品药品监督管理局发布了关于落实《国务院办公厅关于开展仿制药质量和疗效一致性评价的意见》有关事项的公告(2016年第106号),其中提到:“在中国境内用同一条生产线生产上市并在欧盟、美国或日本获准上市的药品,由受理和举报中心负责申报资料受理;一致性评价办公室通知食品药品监管总局药品审评中心(以下简称药审中心)对原境内、外上市申报资料进行审核,通知食品药品监管总局食品药品审核查验中心(以下简称核查中心)对生产现场进行检查。经一致性评价办公室审核批准视同通过一致性评价。”
2017年4月,CFDA发布了新一批35个临床数据自查和第15批优先审评名单。其中,石药集团(1093.Hk)下属石药欧意药业的盐酸二甲双胍片,其上市申请3月2日获得CDE承办受理,一个多月后便同时出现在临床自查和拟优先审评名单里,而CDE给出的优先审评理由是——“同一生产线生产,已在美国上市,申请国内上市的仿制药”,这是CDE首次以这个理由拟将一个品种纳入优先审评。
而自第一家品种通过一致性评价后,审评中心三年后不再受理其他药品生产企业相同品种的一致性评价申请。市场操作中,对于通过一致性评价的品种,政府不仅允许企业在说明书中标示,还在医保支付、招标采购方面给予重大支持。同时,如果3家以上通过一致性评价的,不再集中采购未通过一致性评价的品种。
由此可见,随着行业集中度提高,通过仿制药一致性评审的普药将进入真正的蓝海。
五、仿制药品国外注册,一条艰难迂回但能走通的路
加入ICH将促进中国药品审评机制与其他国家的互相认可,这样做能明显加快中国医药市场国际化的进程,帮助进口药品更快地在国内上市,同时国内的药品也能更快走向国际。
这里要说明,ICH指导原则并不具备法律效力。通常,药品规制的相关文件按执行效力层级可以分为三层,最高是法律(law),其次是规范(regulation),最后是指南性文件(guidance),ICH的注册技术指导原则属于第三层次。
但由于ICH的注册要求和技术指导原则普遍被成员国和非成员国所援引。例如东南亚国家、韩国、南非、以色列等国,在医药产业创新研发时都采用了“ICH指导原则”,中国的新版GMP部分内容也借鉴了其中的精神。所以,加入ICH,对“形成新药研发数据和注册的国际互认”具有重要的作用。
目前,国内优秀的制药厂商陆续在美国FDA进行ANDA注册(新药简略申请,即仿制药),这是一条艰难的国际化道路,但一旦走通,很快会实现良性循环。
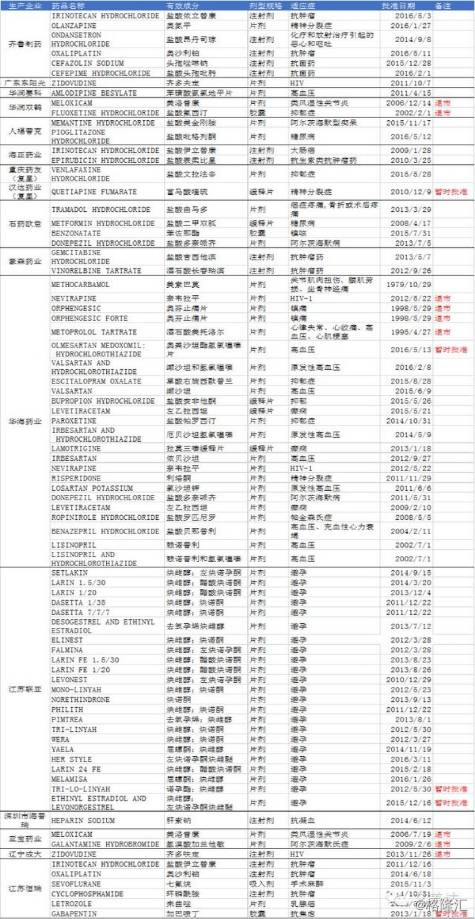
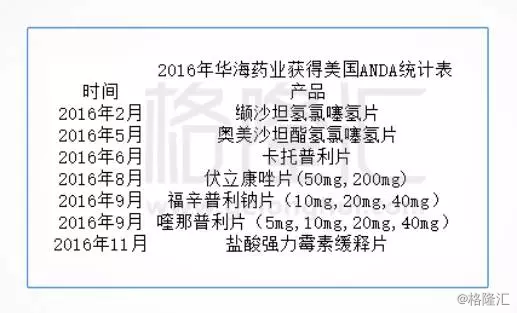
下表是截止2016年国内企业在FDA上市的仿制药品种(不完全统计),以国内企业在美国获得ANDA为标准,涉及16个企业80个品种(包括已退市的产品):
根据最新统计数据,2016年国内药企在美国一共拿到了22个ANDA,其中,华海药业全年共获得7个ANDA批件,是中国本土药业2016年获ANDA最多的药企。
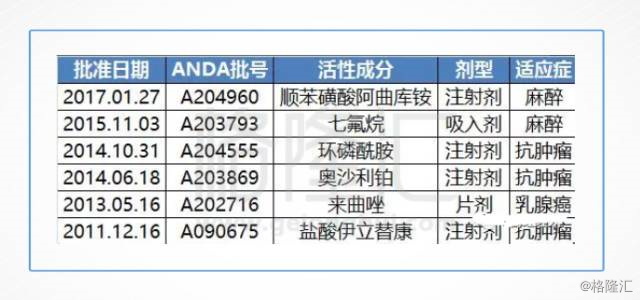
而另一个医药巨头恒瑞医药于2017年1月麻醉用药顺苯磺酸阿曲库铵ANDA申请获批,顺苯磺酸阿曲库铵是恒瑞的当家重磅之一,2015年国内销售额近10亿元。
海外业务如今正在为恒瑞医药贡献着巨额利润,据恒瑞医药2015年年报,其当年出口制剂产品在欧美市场实现放量,收入同比增长高达592.55%。到了2016年,其年报表示,以环磷酰胺为代表的公司出口制剂产品,在国外规范市场稳步增长,推动了公司的营业收入和利润增长。恒瑞2016年海外营收为4.32亿元,较2015年增长了21.47%。
下表是目前恒瑞获批的ADNA:
根据2016年中国海关最新数据,化学药物制剂对欧美、日本出口近350亿元,其中对美国出口增长超过40%,其发展势头与鼓励优秀企业制剂转型有关。我国现有75家药企的几百个制剂产品在南美、俄罗斯、东欧、东盟、非洲注册上市,100多个制剂通过了美国FDA审查。我国本土的前100强医药企业2016年制剂出口远大于4%的水平,达到增幅12%以上,其中前10强增速高达100%。预计华海、恒瑞、海正、绿叶等今年增幅更大。
六、结语
国家食药监总局加入ICH将是中国药品注册技术领域发展的一个里程碑。这不仅意味着中国的药品监管部门、制药行业和研发机构将逐步转化和实施国际最高技术标准和指南,推动国际创新药品早日进入中国市场,满足临床用药需求,还将提升国内制药产业创新能力和国际竞争力。
可以预见,在监管要求提高的同时,中国和国际药品注册技术将要求协调一致,这对开展国际注册的制药企业而言,未来可以按相同的技术要求向多个国家或地区的监管机构进行申报,大大节约研发和注册的成本。加入ICH也将会推动越来越多的中国企业加入国际注册的行列。
通过实施ICH指导原则,也会加深中国制药企业对药品注册国际技术要求的理解,提高国际注册的成功率。这是药品注册领域真正的与国际接轨。但这同时也意味着中国医药产业将参与全球竞争,在与国际技术要求方面的差异不断缩小乃至消失的同时,中国药企也面临着创新压力。
对于一直处于吃着创新药利润的仿制药企业而言,要么成长为真正的创新型企业,要么转型成彻底的国际性仿制药企才是未来的出路,在这个领域,成立于1984致力于非专利药品、专利品牌药品和活性药物成分的研究开发、生产和推广的以色列梯瓦制药工业有限公司(Teva Pharmaceutical Industries Limited,NASDAQ: TEVA)或许是最好的研究对象。
而对于整个仿制药行业而言,有着“世界药房”之称的印度可以参考。目前印度生产了全球20%的仿制药,并使制药业成为印度经济的支柱之一。印度境内拥有FDA认证的药厂共有119家,可向美国出口约900种获得FDA批准的药物和制药原料;拥有英国药品管理局认证的药厂也有80多家。印度的药品出口到200多个国家,疫苗和生物制药产品出口到150个国家。
而对于在药物研发上已经占据领先通道的大型创新药企而言,这个利好将会实实在在反应在未来的业绩增长上,尤其是已经拥有全新化合物专利的优质药企。
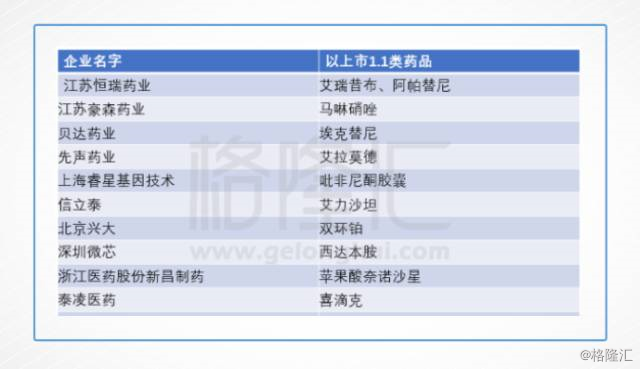
(2011年—2017年国内批准上市的1.1类新药)
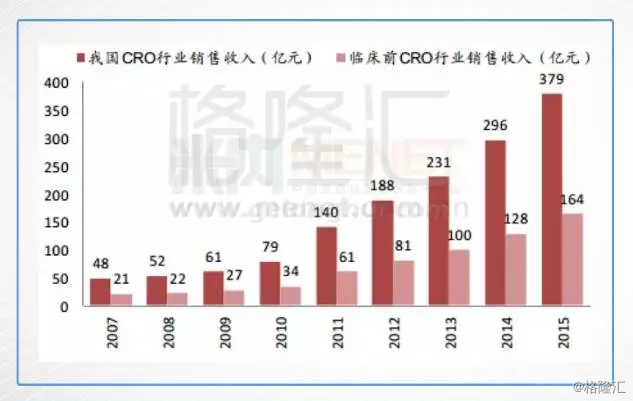
当然,除了大型创新型药企,由于创新药国内市场开发和国际同步,中国国际多中心临床试验的重要性将大大提高,未来中国国际多中心临床试验项目有望大幅增长。国内临床试验 CRO 龙头企业:药明康德、泰格医药均会迎来更好的发展机遇。它们可能成为医药行业里的隐形冠军。
在监管层面,加入了ICH,国家食药监总局将积极参与ICH相关工作,同时将进一步推进ICH技术指导原则在国内的转化和实施。从短期看,我们只能遵从发达国家的政策监管要求与约束,但从长期看,加入精英俱乐部,应该立足于在标准制定的领域发出自己的声音这个终极目标。
我们凭借什么来达到这个长远目标呢?一定是产业规模,而且是具备先进技术的产业规模,中国必须诞生一批在国际市场上有创新力、有影响力的医药企业,才有可能实现这个目标。
附:ICH目前成员和观察员
Current Members and Observers初创成员
• The European Commission (EC)欧盟
• The US Food and Drug Administration (FDA)美国FDA
• The Ministry of Health, Labour and Welfare of Japan (MHLW) also
represented by the Pharmaceuticals and Medical Devices Agency (PMDA)
日本厚生省和药品医疗器械管理局 初创行业组织
• The European Federation of Pharmaceutical Industries and Associations (EFPIA)欧洲制药工业协会
• The Japan Pharmaceutical Manufacturers Association (JPMA)日本制药行业协会
• The Pharmaceutical Research and Manufacturers of America (PhRMA)美国药物研发与制药工业协会
Standing Regulatory Members常任监管机构成员
• The Health Canada 加拿大卫生部
• The Swissmedic 瑞士卫生部
Regulatory Members监管机构成员
• The CHN Food and Drug Administration(CFDA)中国食品药品监督管理总局
• The Agência Nacional de Vigilância Sanitária (ANVISA, Brazil)巴西药监局
• The Ministry of Food and Drug Safety (MFDS, Republic of Korea)韩国食品药品安全部
Industry Members行业组织成员
• The Biotechnology Innovation Organisation (BIO) 生物技术创新组织
• The International Generic and Biosimilar Medicines Association (IGBA)国际仿制药和生物类似物协会
• The World Self-Medication Industry (WSMI) 国际自我药疗产业协会
Standing Observers观察员
• The International Federation of Pharmaceutical Manufacturers and Associations (IFPMA) 国际制药工业协会联合会
• The World Health Organisation (WHO)世界卫生组织
Observers in Legislative or Administrative Authorities司法行政区或监管机构观察员
• The Central Drugs Standard Control Organization (CDSCO, India) 印度药品监管局
• The Centro para el Control Estatal de Medicamentos, Equipos y Dispositivos Médicos (CECMED, Cuba) 国家药品、医疗器械和装备控制中心
• The Comisión Federal para la Protección contra Riesgos Sanitarios (COFEPRIS, Mexico)墨西哥卫生部
• The Health Sciences Authority (HSA, Singapore)新加坡卫生部
• The Medicines Control Council (MCC, South Africa)南非药品控制局
• The National Center for the Expertise of Drugs, Medical Devices and Equipment (National Center, Kazakhstan)哈萨克斯坦药品医疗器械及社会国家中心
• The Roszdravnadzor (Russia)俄罗斯药监局
• The Food and Drug Administration (TFDA, Chinese Taipei) 中国台北食品药品监管局
• The Therapeutic Goods Administration (TGA, Australia)澳大利亚治疗产品管理局
Regional Harmonisation Initiatives (RHIs)区域性协调行动组织
• The Asia-Pacific Economic Cooperation (APEC)亚太经合组织
• The Association of Southeast Asian Nations (ASEAN)东南亚国家联盟
• The East African Community (EAC)东非共同体
• The Gulf Health Council (GHC)海湾健康委员会
• The Pan American Network for Drug Regulatory Harmonization (PANDRH)泛美药品协调网络
• The Southern African Development Community (SADC)南非发展协会
International Pharmaceutical Industry Organisation国际药品行业组织
• The Active Pharmaceutical Ingredients Committee (APIC) 活性药物成分协会
对药品领域关注的国际组织
International Organisations with an Interest in Pharmaceuticals
• The Council for International Organizations of Medical Sciences (CIOMS)国际医学组织理事会
• The European Directorate for the Quality of Medicines & HealthCare (EDQM)欧洲药品质量管理局
• The International Pharmaceutical Excipient Council (IPEC)国际药用辅料协会
• The United States Pharmacopeia (USP)美国药典会
 下载格隆汇APP
下载格隆汇APP
 下载诊股宝App
下载诊股宝App
 下载汇路演APP
下载汇路演APP

 社区
社区
 会员
会员