作者:天风证券 郑薇/杨烨辉团队
事件:
12月22日晚,CDE发布《关于公开征求<已上市化学仿制药(注射剂)一致性评价技术要求>意见的通知》。
注射剂一致性评价有望明年上半年拉开帷幕,7000亿元市场面临格局重塑。
本次关于注射剂一致性评价的征求意见稿的出台进一步细化了执行细节,征求意见截止时间为2018年1月25日。我们认为,本次注射剂一致性评价技术要求的正式文件有望在明年上半年正式出台,注射剂一致性评价工作有望在明年正式拉开帷幕。中康CMH数据显示,我国2016年注射剂市场规模达到7577亿元,其中化学药注射剂占比72%,预计2020年国内注射剂规模将超过一万亿元,化学仿制药注射剂市场超过7000亿元,注射剂一致性评价将使得国内化学仿制药注射剂7000亿元市场面临格局重塑。
注射剂一致性评价有望明年上半年拉开帷幕,7000亿元市场面临格局重塑
2016年3月5日国务院办公厅发布《关于开展仿制药质量和疗效一致性评价的意见》,意见指出:“化学药品新注册分类实施前批准上市的仿制药,凡未按照与原研药品质量和疗效一致原则审批的,均须开展一致性评价。”;2017年10月8日中共中央办公厅、国务院办公厅联合印发的《关于深化审评审批制度改革鼓励药品医疗器械创新的意见》中指出“对已上市药品注射剂进行再评价,力争用5至10年左右时间基本完成;通过再评价的,享受仿制药质量和疗效一致性评价的相关鼓励政策”。本次关于注射剂一致性评价技术要求的征求意见稿的出台进一步细化了执行细节,征求意见截止时间为2018年1月25日。我们认为,本次注射剂一致性评价技术要求的正式文件有望在明年上半年正式出台,注射剂一致性评价工作有望在明年正式拉开帷幕。中康CMH数据显示,我国2016年注射剂市场规模达到7577亿元,其中化学药注射剂占比72%,预计2020年国内注射剂规模将超过一万亿元,化学仿制药注射剂市场超过7000亿元,注射剂一致性评价将使得国内化学仿制药注射剂7000亿元市场面临格局重塑。
区分不同类别注射剂一致性评价的技术要求,疗效确切的成熟产品有望首批通过一致性评价
1、 已上市证明药学已上市注射剂属于具有完整和充分的安全性、有效性数据的,或被FDA橙皮书收载的,需按照要求和国内外相关技术指导原则展开一致性评价,我们认为该种类型注射剂有望成为首批通过一致性评价的品种;
2、 已上市注射剂不具有完整和充分的安全性、有效性数据的,开展药品再评价。长期以来,我国存在大量中国特色的注射剂产品,这些产品将面临药效再评价的压力,部分安全无效的或无法充分证明临床效果的注射剂型将面临退出市场的压力;
3、 特殊注射剂型的生产工艺可能影响药物体内行为,预计部分产品除了药学研究,还需做BE或临床试验,一致性评价成本相对较高,周期相对更长,但将更具有进入壁垒;
4、 改规格、改剂型、改盐基注射剂一致性评价,需要通过药学研究充分论证相应改进的必要性或临床优势,众多通过该类型改变的独家品种市场准入和价格体系未来将面临考验。
注射剂供给侧改革推进,利好高质量注射剂龙头公司
注射剂由于不经过消化道吸收直接进入血液,对安全性有着更高的要求,而我国由于历史原因,大量处方工艺、原辅料和杂质质量研究不到位的产品充斥市场,上市产品质量参差不齐,给我国注射剂临床使用造成了极大不良影响;同时长期以来,我国注射剂产品乱象并存,部分安全无效或临床疗效不明确的产品大量充斥市场,对我国有限的医疗资源是极大的浪费。本次注射剂一致性评价的出台,将是对国内注射剂行业的供给侧改革,对资金实力有限的公司、原始工艺研究不到位以及部分安全无效的产品将面临重大的考验,而以下两类公司将从中获益:
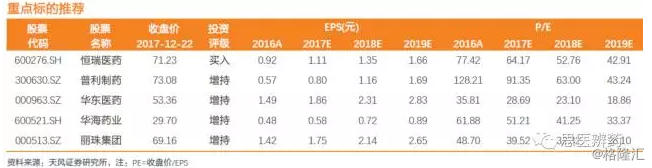
1、注射剂制剂出口龙头公司,本身产品经过FDA或EMA的认证或未来有望通过海外认证,海外注射剂产品有望获得优先审评并视为通过一致性评价,关注恒瑞医药、普利制药、华海药业;
2、国内注射剂龙头公司,本身拥有雄厚的资金实力和高质量的注射剂研发生产水平,未来国内产品有望率先通过一致性评价,关注恒瑞医药、科伦药业、复星医药、华东医药、丽珠集团,以及港股中国生物制药、绿叶制药、三生制药等。
风险提示
政策推进进度低于预期,执行力度低于预期。
 下载格隆汇APP
下载格隆汇APP
 下载诊股宝App
下载诊股宝App
 下载汇路演APP
下载汇路演APP

 社区
社区
 会员
会员



