作者:兴业证券医药小组
本文来自兴证医药健康,原标题《寻找“红海”中的“蓝海”(上篇)—中外仿制药定价与销售深度报告【美日篇】》
自2015年以来,药政巨变,为国内创新药和优质仿制药带来发展机遇,特别是一致性评价政策的推出,有利于国产优质仿制药实现弯道超车。长期来看,专利过期原研药的品牌溢价将会逐渐消失,仿制药行业集中度会进一步提高。2018年是我国仿制药一致性评价品种通过的元年,我们认为也是我国由仿制药大国崛起为强国的起点。在这个时点,我们发布近70页的《寻找“红海”中的“蓝海”—中外仿制药定价与销售深度报告》,报告中追溯了美国和日本的仿制药发展历程,试图为中国仿制药行业发展路径寻找一定的方向。我们认为国内能够实现进口替代,出口转内销以及工商一体化企业将受益,成为仿制药“红海”中的“蓝海”。此为报告的第一篇:美日篇。
一、美国启示录:全球最大仿制药消费国发展路径追溯
1.1 美国仿制替代原研之路
近年来,全球药品市场迅速发展,根据前瞻产业研究院《中国医药行业“十三五”市场前瞻与发展规划分析报告》的数据统计,2016年全球医药市场规模达到11100亿美元,2011-2016年复合增长率高达6%,美国市场占比40%以上。根据IMS数据库统计,2016年全球仿制药市场规模达到2200亿美元,美国是全球最大的仿制药消费国,2016年美国市场仿制药销售总额约为800亿美元。Evaluate Pharma预计未来几年,美国仿制药市场年复合增长率将达到9.1%,2020年仿制药销售额将突破1100亿美元。
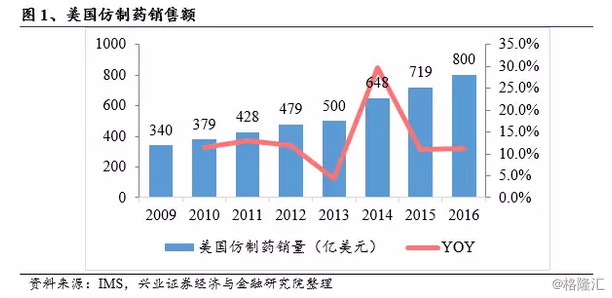
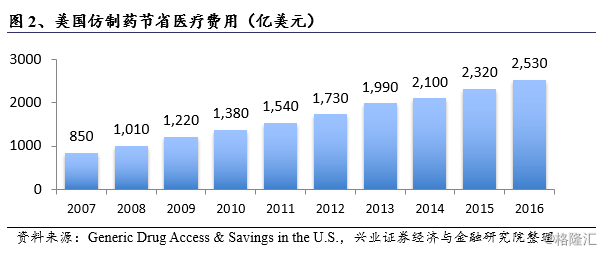
由于全球人口结构老龄化的加深、新药价格越趋昂贵,使得医保支付压力日益沉重,多国政府开始积极鼓励使用仿制药。美国的医疗卫生费用支出位居全球第一,2016年美国医疗卫生总支出达3.3万亿美元,占GDP的17.9%。低价仿制药的普及给美国医疗卫生体系带来了可观的开支节约,据统计,过去十年共节省了16700亿美元,其中2016年节省2530亿美元,超过当年仿制药销售额。
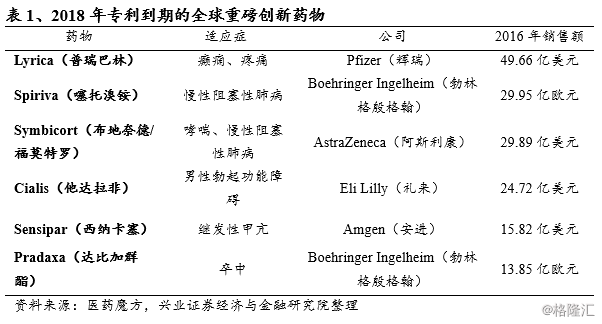
另一方面,随着全球重磅创新药物专利到期,导致越来越多的仿制药上市销售。在专利保护到期后,由于仿制药的竞争压力造成的原研药销售额大幅下降成为“专利悬崖”。
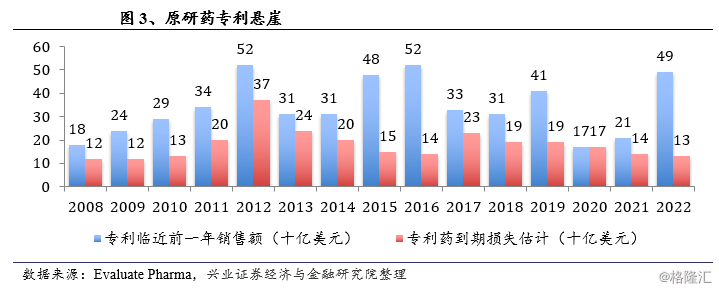
根据Evaluate Pharma发布的报告,2018-2022年将有1590亿美元的药品面临专利到期,预计对原研药企业造成的损失为820亿美元。面对“专利悬崖”,原研药企业可能会选择退出市场或降低产量,仿制药将迎来快速占据市场的机会。
纵观美国仿制药行业的成长路径,大致分为3个阶段:
● 宽松管理,初步萌芽
上世纪初,美国药品上市要求与一般商品相同,无需安全性与有效性的证明。1938年,美国一家公司生产的抗炎症药物造成医疗事故,此后美国政府要求上市药品必须具备安全性并向FDA申报,但只需提交公开文献资料证明安全性。直到二战之前,美国制药市场基本由欧洲生产商垄断,二战期间为了满足战争用药要求,美国仿制药行业逐渐兴起,并在战争结束后继续依靠欧洲原研药赚取利润。
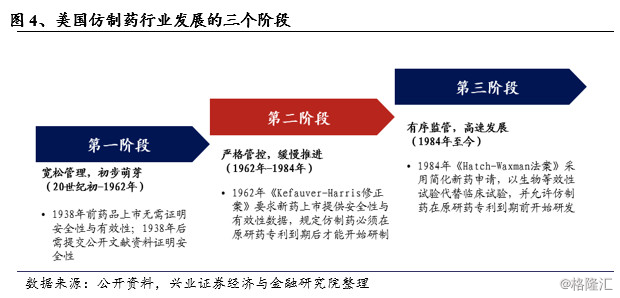
● 严格管控,缓慢推进
1962年以前,FDA只负责审批药品的安全性。1961年,在欧洲、加拿大等多个国家上市的“反应停”药物被指出造成上万名婴儿畸形,该事件促使美国政府于1962年通过《Kefauver-Harris修正案》,从此之后,新药在上市前,必须要向FDA提供证明其安全性及有效性的数据,修正案规定仿制药须在原研药的专利全部到期后才可以进行研制,同时所有新药申请不仅需要证明其安全性,还需要提供证明有效性的临床研究数据,由此带来的上市时间延长与临床研究高额费用导致仿制药市场发展缓慢,极大的限制了研制仿制药的商业动力。至1983年,专利到期的原研药中只有35%存在相应的仿制药竞争,且市场份额平均仅有13%。与此同时,药物价格高涨,给政府、保险公司、民众带来了巨大的经济负担。
● 有序监管,高速发展
在此背景下,《Hatch-Waxman法案》(《药品价格竞争和专利期保护法》,俗称《仿制药法》)于1984年9月由美国国会签署通过,自1984年11月起正式实施,该法案创造了仿制药的现代审批体系。对于仿制药而言,该法案采用了简化新药申请(Abbreviated New Drug Application,简称ANDA),以生物等效性(Bioequivalence,BE)试验代替此前的临床试验,Hatch-Waxman法案假设生物等效性是药品安全性和有效性的一个良好的替代指标;并允许仿制药在原研药专利到期前开始研发,大幅降低了仿制药研发上市所需的时间与费用。
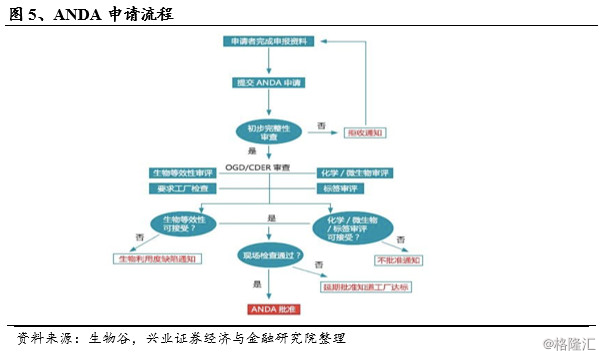
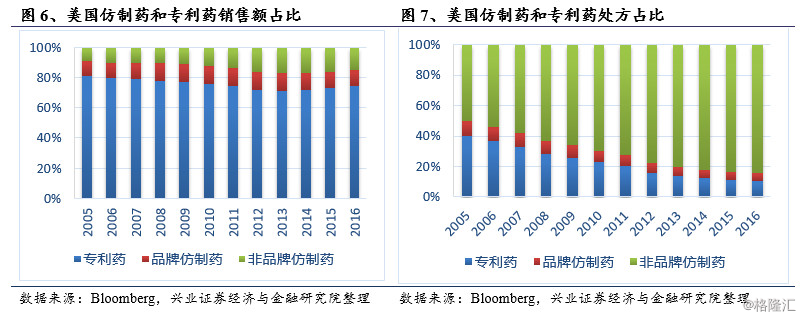
此后,美国仿制药行业进入了高速发展阶段,仿制药销售量占总处方量的比例不断上升,仿制药占处方药的比例从1980年代早期的10%增加到2013年的86%。由于新药研发难度的增加和美国政府对仿制药的提倡,这一比例持续增加,2016年,仿制药占有处方的90%,专利药占处方10%;仿制药占药物销售额的20%,专利药占药物销售额80%。
1984年的Hatch-Waxman法案不仅建立了现代仿制药的审批制度和流程,对适用于药品的专利法也做出了重大的更改。由于Hatch-Waxman法案简化了仿制药的申请,降低仿制药上市成本,从而打击了新药研发企业的积极性。为了平衡专利药和仿制药的利益,美国国会在推出简化新药申请ANDA的同时,也推出了专利链接制度,制度包括药品专利期限延长、数据保护制度、试验豁免例外和专利挑战180天独占权等内容。
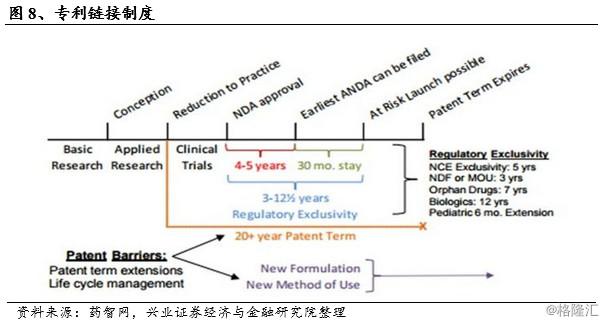
具体包括:1)延长原研药厂家的专利期限,以弥补由于FDA审批所带来的专利时限的消耗;2)通过专利侵权豁免规定。仿制药研发厂家在原研药的专利年限内,只要符合FDA的法规,就可以进行仿制药的研发,而不会被认为侵权;3)设立机制来保障挑战原研药专利的合法性,对原研药专利的合法性、可执行性,或侵权性进行挑战的行为设立奖励政策;4)给予FDA一定的权利,为药厂提供专利期之外的一定市场独占期。
《Hatch-Waxman法案》指令FDA公布所有经其批准的经过治疗等效性评价批准的药品信息,包括审批通过日期、专利情况与独占期等,该名录简称橙皮书(Orange Book)。法案要求ANDA提交时必须递交以下四种声明之一:I:该药品在橙皮书中无专利;II:该药品在橙皮书中有专利,但已经失效;III:在相关专利失效前,不要求FDA批准该仿制药;IV:与申请的仿制药相关的专利是无效的,或仿制药不侵权。
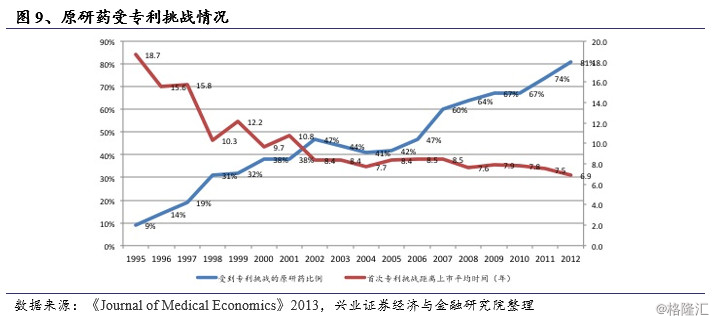
按照法案规定,首个包含声明IV(专利挑战)并成功的仿制药将获得180天的市场独占期,在此期间FDA不再批准其他仿制药的上市。由此,首仿药得以先于其他仿制药抢占市场,并有可能在此后多年占据市场主要份额。同时首仿药在180天独占期中能以创新药50-80%的价格销售,获得高额利润。以巴尔制药公司为例, 2001年成功挑战当时年销售额24亿美元的百忧解,6个月后市场份额便达到82%,期间获得约2.5亿美元盈利。首仿药的巨额回报吸引了众多仿制药生产商的激烈争夺,据统计,1995年至2012年,新药专利受到挑战的比例从9%上升到了82%,其中销量超过10亿美元的药物受到挑战的比例高达91%。首次受到挑战时间与上市时间间隔从18.7年下降至6.9年,独占期的出现大幅推动了仿制药对原研药的替代。
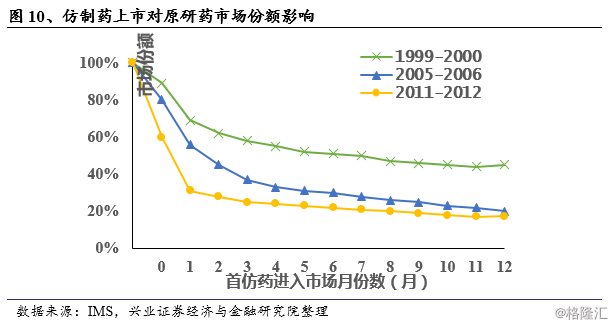
根据IMS统计数据,原研药专利到期后,市场份额将快速被仿制药占领,且这一占领速度呈现逐年加快的趋势:例如1999-2000年到期的原研药在首仿药进入市场2个月后尚有70%的市场份额,而2011-2012年到期的原研药在首仿药进入市场2个月后仅剩30%市场份额,10个月后占比进一步下降至20%。
本节小结:本节主要回顾世界上最大的仿制药市场——美国的仿制药行业发展之路。美国仿制药行业经历了三个主要阶段:宽松管理,初步萌芽;严格控制,缓慢推进;有序监管,高速发展。1984年通过的《Hatch-Waxman法案》对推动美国仿制药发展起到关键作用,不仅建立了现代仿制药的审批制度和流程,对适用于药品的专利法也做出了重大的更改,推动了美国仿制药替代原研之路。
1.2 仿制药引入价格竞争,药商成最大赢家
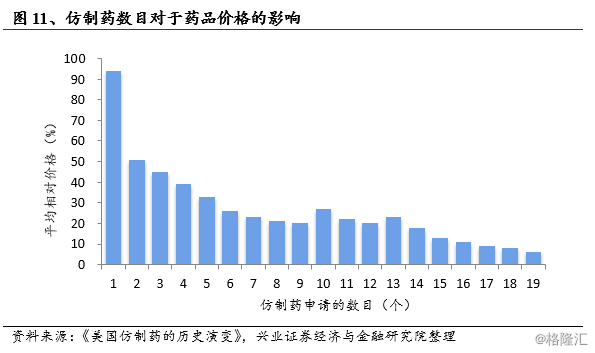
Hatch-Waxman法案在保护原研药生产商专利权同时,把价格竞争引入处方药市场。仿制药使得整体药品价格明显回落,我们发现最大幅度的价格下降,发生在第二个仿制药上市之后。
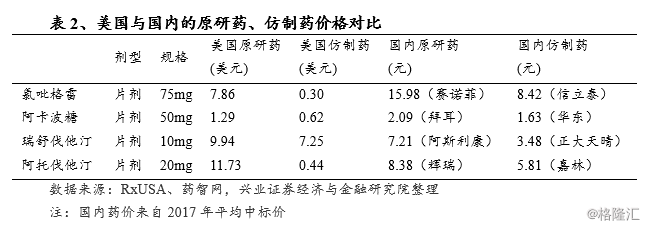
以氯吡格雷75mg片剂为例,RxUSA网站标示的原研药价格为7.86美元/片,而同一规格的仿制药只需0.30美元/片,不足原研药价格的4%。
美国仿制药的买家基本上分为三类:批发商、药店、PBMs。美国的药品批发商经过十年的淘汰,从200多家少至50家,前三家占有了96%以上批发业务,批发业务呈高度集中态势。在美国药品流通领域主要有三大巨头:McKesson、AmerisourceBergen和Cardinal,已度过了通过上下游整合兼并扩大市场份额的阶段,即使兼并整合也是优化产业及自身价值链,目前均由纯粹的药品分销、配送向服务转型:对上游生产企业提供全方位方案解决服务,例如在当地的招标、物价、报销及医生教育工作;对下游医疗机构不仅保证药品配送品种齐全、即时到位及药品质量,同时提供提升医院收益、药品治疗、药房管理体系方案及药剂人员知识和技能提升方案、患者信息收集运用方案;针对零售药店,还提供药店低成本运作方案、药店信息集成运用方案、患者用药教育方案,并最终提供社区及家庭的健康管理方案。
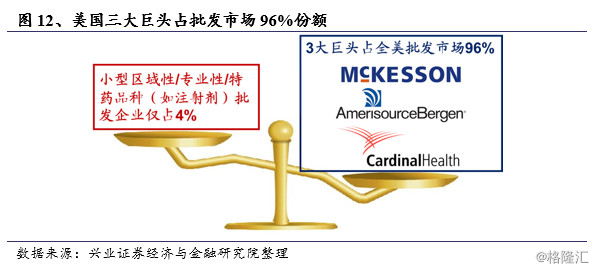
第二大买家是药店,美国的药店分两大类:一种是传统形式的药店,主要是处理处方配方业务,有个体经营、连锁零售、超市附属的连锁药店等形式。第二种是现代形式的药店,具有处方配送、长期健康管理等功能。
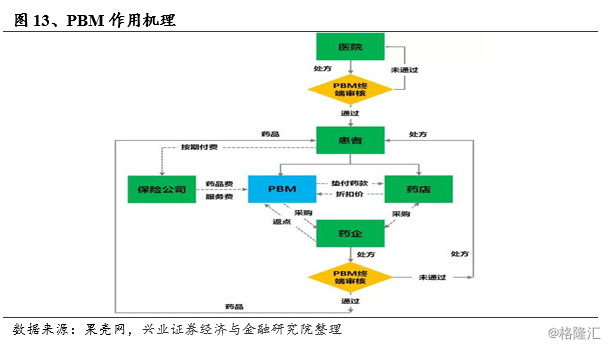
药品福利管理PBM(Pharmacy BenefitManagement)是美国流通领域当中核心的环节,不直接拥有药品或控制处方,但是确定费用。根据美国权威的NICD(全国药店连锁行业协会)的估计,2013年美国的三分之一的处方是由PBMs处理,作为协调管理方介于保险机构、药品生产商、医院与零售终端之间,负责制定与管理药品处方,与药品制造商谈判折扣和回扣,以及处理和支付处方药索赔等。PBM主要起到监管医生与药剂师行为、控制药品费用增长的作用。作为盈利机构,PBM主要通过向被代理机构收取管理费用、向药品生产商要求返点获得收益。为了更好的实现成本控制,提高利润,PBM会尽可能增加仿制药的使用,例如减少仿制药自付比例,通过一定激励引导药剂师多开仿制药等。
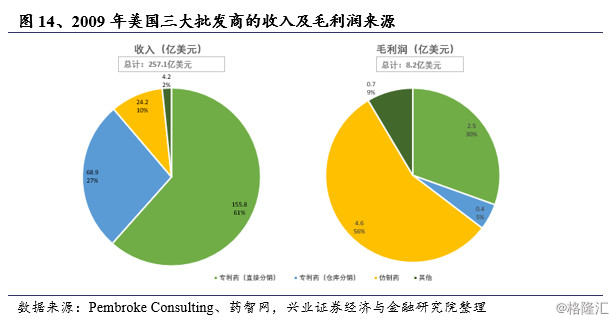
美国药品从生产商到达销售终端主要由批发企业提供第三方外包物流服务,完善的医药分家与药品分类管理制度使得零售终端占据了药品消费的主导地位。零售药店通常选择与批发商形成稳定同盟,主要通过批发商采购药品。因此,药品批发商在药品定价中具备一定的话语权,能够通过衡量市场容量与竞争程度与生产商谈判协商。与创新药相比,仿制药由于存在多个供应商,存在更大的议价空间。2009年,美国三大批发商的收入10%来源于仿制药,而毛利润56%来源于仿制药。
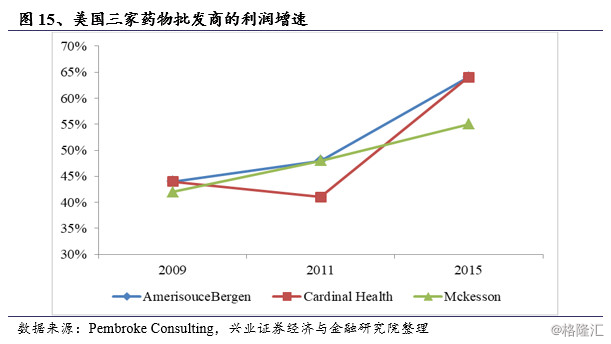
在仿制药的采购过程中,通过PBMs算出零售价格,药商压低采购价格,越是垄断的药商,上游议价能力就越强,仿制药价格越低,利润也越高。美国在鼓励销售仿制药的同时,也把仿制药的利润割让给了销售商。美国三家药物批发商McKesson、AmerisourceBergen和Cardinal的利润增速从2009年以来持续提升。
本节小结:仿制药门槛较低,价格和销售是仿制药的重中之重。美国仿制药最大幅度的价格回落,发生在第二个仿制药上市之后,也就意味着获批首仿药对仿制药企业来说至关重要。美国仿制药的买家基本上分为三类:批发商、药店、PBMs。三大药品批发商基本垄断仿制药批发市场;药品福利管理PBM则有权确定费用,计算零售价格。由于垄断销售商议价能力很强,美国在鼓励销售仿制药的同时,也把仿制药的利润割让给了销售商。因此,美国仿制药行业发展过程中,医药流通和零售巨头也是获益标的。
1.3 美国医保杠杆调节仿制药使用
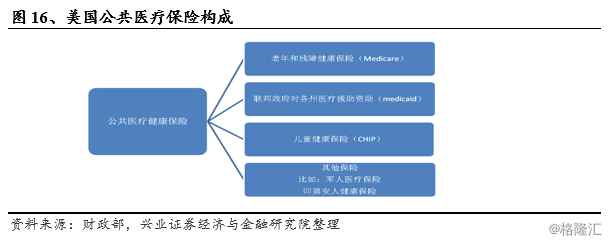
美国医疗保险由私人医疗保险与公共医疗保险组成。私人医疗保险一般为商业医疗保险,由盈利性保险公司提供,公共医疗保险由政府主导,公共医疗保险惠及面最广的为医疗照顾(Medicare)与医疗救助(Medicaid),前者针对65岁以上的老年人与部分重症患者,后者针对低收入群体。2016年底,美国3.25亿人中约16%享受医疗照顾,25%享受医疗救助与儿童健康保险(CHIP),51%参加商业医保,剩余8%则无医保覆盖。
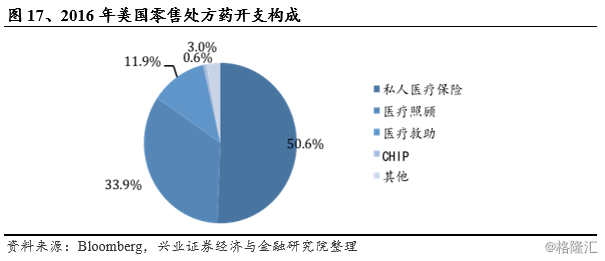
2016年私人医疗保险与医疗照顾占据了零售处方药开支的80%以上份额,两类医保在实际报销时均采取一定措施鼓励仿制药的使用。私人医疗保险通常设置多个等级的报销目录,等级越低报销比例越高。仿制药通常位于最低等级,患者自付金额不超过10美元,而等级较高的创新药则需自付几十至上千美元不等。通过不同报销比例的设置,商业保险公司引导消费者选择价格较低的仿制药。除此之外,商业保险公司也通过限制一定时间内用量、要求医生陈述药品选择的合理理由、制定优先使用目录中相对便宜药品等方法限制医保支出,一定程度上提高仿制药使用比例。与之类似,医疗照顾中的处方药计划(Part D)也采取了一定的激励措施提高仿制药使用比例,如提高原研药共付率等。
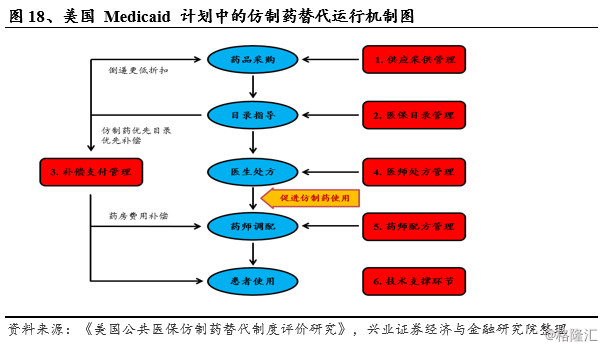
● 美国Medicaid计划仿制药替代制度
我们以美国公共医疗保险的Medicaid 计划为例,分析美国公共医疗保险仿制药替代体系运行机制:美国Medicaid计划仿制药替代制度是美国联邦和州政府为特殊人群提供的在州层面实施的医疗救助项目,该计划由美国国会1965年通过修订《社会保障法案》(Social Security Act)颁布实施,旨在为经济困难的特殊人群提供长期的医疗保障,费用控制成为Medicaid计划管理中的重要议题。
Medicaid计划于1975年开始探索仿制药替代行为,到目前,美国已建立了一个通过立法授权仿制药等效产品替代处方中创新药的体系,即除非处方标明不得替代或患者拒绝仿制药替代,处方中创新药可以被相应仿制药替代。仿制药替代制度大幅提高了Medicaid 计划中价格相对低廉的仿制药的处方占比,应用于美国Medicaid 计划的药品供应采购、医保目录管理、补偿支付、药品使用(医师处方、药师配方)等药品生命周期的各个重要环节中,通过各种措施规范药企、医疗机构、药店、患者等的行为,充分促进仿制药替代,实现节省药品支出的政策目标。
● 药品供应采购管理—药品折扣计划(Drug Rebate Program)
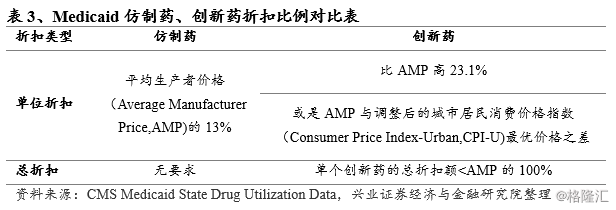
医疗保险现代化法案(Medicare Modernization Act,MMA)等规定,任何向 Medicaid计划提供药品的企业都应向健康与人类服务部(Department ofHealth and Human Services,HHS)提交一份折扣协议,换取联邦对Medicaid患者按项目付费的门诊药费的医保补偿;未签订折扣协议的制药企业,其产品没有资格获得联邦Medicaid的补偿。Medicaid计划中创新药与仿制药折扣比例的巨大差距,以及针对创新药总折扣的限制条件,事实上都极大促进了仿制药的替代使用。
● 医保目录管理—优先药品目录(Preferred Drug Lists/Formularies)
美国各州政府根据Medicaid计划制定相应的优先药品目录,进入该目录的药品将被优先使用,而未进入目录的药品若希望通过Medicaid计划被患者使用,需提前申请预先许可(PriorAuthorization)。优先药品目录直接鼓励仿制药进入目录,而创新药的使用则可能需要获得预先许可。
● 补偿支付管理
Medicaid计划通过药房费用补偿和患者共付费用两项措施实施仿制药替代制度。
药房费用补偿包括两方面:1)向药房支付配药费(Dispensing fees),通常各州Medicaid计划向仿制药处方所支付的配药费要高于为创新药处方支付的费用。2)对药品采购成本设置支付上限,对于多来源药物(即有三个或三个以上疗效等效性的仿制药的治疗项目),Medicaid计划在向门诊药房提供药品采购成本时设置联邦价格上限(FederalUpper Limit,FUL),即仿制药最低价格的150%。除了联邦价格上限,各州的 Medicaid 计划可自行对多来源药物的支出设置支付上限,即州最大允许费用(Maximum allowable cost,MAC)。MAC可以比FUL 还要低。

Medicaid计划对仿制药和创新药的每张处方制定了不同的患者共付费用。根据不同的收入状况,Medicaid计划以联邦贫困水平(Federal Poverty Level,FPL)为标准,将受益人分为两个层次制定不同的患者共付费用。非优先使用药物通常是价格昂贵的创新药,Medicaid计划对于仿制药和创新药的患者共付费用存在差异,当受益人收入超过150%FPL时,差异尤其明显,患者的共付费用是促使其选择使用仿制药的最大动因。

● 医师处方管理和药师配方管理
对医师处方行为进行管理是从源头促进仿制药替代的控制措施,因此 Medicaid计划通过较少的仿制药处方限制及分步疗法(StepTherapy/Fail First Policies)等方式对医保处方进行管理。分步疗法是指受益人在使用二线药物(通常是创新药)之前必须先尝试使用过一线药物(通常是仿制药),且由医师证明一线药物对其无效。Medicaid计划为仿制药处方所支付的更高的配药费是激励药师在处方调配过程中进行仿制药替代的重要经济因素。医师的处方行为和药师的调配行为是仿制药替代制度的最终目的,而这两个环节的技术支撑即 FDA 发布的《具备疗效评价的已批准药品名录》(The Orange Book,橙皮书)。橙皮书公布了指定作为创新药即参比药物的治疗等效性药品,对每一个被批准的药品,FDA都会给一个“疗效等效性”分类编码(TE Code),发布在橙皮书中。
1970-2012年美国Medicaid计划整体支出费用的增长率由1993年之前的350%以上降至2012年的0.84%,在2006年甚至出现负增长。Medicaid计划整体支出费用的增长率发生巨大变化的转折点在1998 年,原因是1980年FDA发布橙皮书作为仿制药替代制度的技术指南之后,仿制药替代才逐步广泛应用,Medicaid计划整体支出费用得到有效控制。
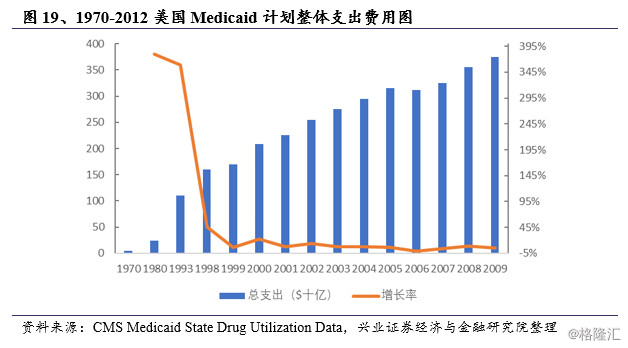
本节小结:本节主要探讨美国医疗保险制度对于仿制药使用的促进作用。以美国公共医疗保险的Medicaid 计划为例,分析美国公共医疗保险仿制药替代体系运行机制:仿制药替代制度应用于药品供应采购、医保目录管理、补偿支付、药品使用(医师处方、药师配方)等药品生命周期的各重要环节中。仿制药替代制度大幅提高了美国仿制药的处方占比,实现了费用控制的目标。
1.4 一致性评价开创美国仿制药新格局
由于仿制药在医疗领域高比例的应用,其安全性与疗效的合理评估一直被FDA所重视。美国1968年开始药物有效性研究实施项目(DESI),对于1938-1962年期间只进行安全性研究而没有进行有效性研究的药品进行评价。DESI并非仿制药生物等效性评价,而是基于历史上药品审评法规不完善进行追溯审查,对药品有效性进行再评价。由专家组依据FDA、药品生产企业、科学文献三方证据,对药品进行审查,并将药物按照功效分成“对其说明书上所列的适应症均有效”、“对所列适应症疗效不明确”、“对所列适应症完全无效”三类,只有被证明有效的药品才允许生产,截至1984年共评定了近4000种药物。
仿制药与创新药的可替换性决定于生物等效性试验,是反映仿制制剂相对于参比制剂生物等效程度的药物制剂质量控制研究项目。这一概念最早源于70年代早期,用于探究不同药品化学特征相同与疗效一致,直到1984年《Hatch-Waxman法案》颁布才用于仿制药质量评估。法案签署的同时,FDA还公布了《经治疗等同行评价批准的药品》(橙皮书),为仿制药替代原研药提供依据。1984-1992年间,FDA发布了大量指南指导企业进行生物等效性试验,并于1990年成立了专门负责仿制药审评检查的仿制药部。2003年,FDA基于生物药剂分类系统(BCS),在颁布的指导原则中提出口服制剂豁免;2004年推出“固体制剂溶出曲线数据库”,详细罗列了溶出度试验各参数与取样时间点。此后2007-2016年间,FDA陆续推出了多种药品的个性化生物等效性指南,对仿制药开发提供具体指导。2012年公布的《仿制药企业付费修正法案》通过由企业缴纳费用的方式完成承诺目标,进一步提高审评效率。

纵观美国仿制药行业的发展,1984年《Hatch-Waxman法案》的正式签署是近半个世纪来最重要的转折点。法案推动了一致性评价的实施,在降低仿制药上市门槛的同时,严格把控药品质量,确保仿制药与原研药之间的可替代性,在不遏制创新力的条件下提高药品更迭速度,降低药品费用支出,由此开创了仿制药行业的全新格局,为美国乃至全球药品行业的发展注入了活力。
本节小结:本节主要对美国的仿制药一致性评价政策进行总结,美国1968年开始药物有效性研究实施项目(DESI),对于1938-1962年期间只进行安全性研究而没有进行有效性研究的药品进行评价。生物等效性试验,是反映仿制制剂相对于参比制剂生物等效程度的药物制剂质量控制研究项目,最早源于70年代早期。从1984年的《Hatch-Waxman法案》颁布开始,美国执行严格的仿制药质量评估,其后陆续出台了一系列政策和法律,在降低仿制药上市门槛的同时,严格把控药品质量,确保仿制药与原研药之间的可替代性,由此开创了仿制药行业的全新格局。
二、日本启示录:提升仿制药比例变革之路
2.1 日本仿制药政策路线图
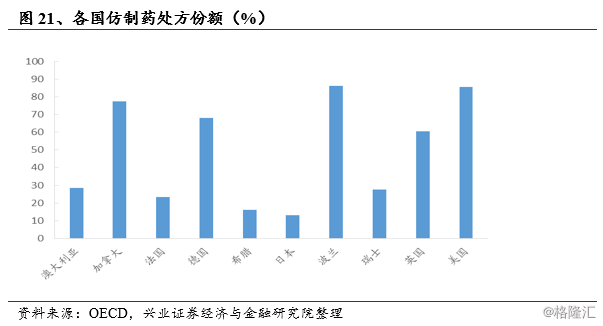
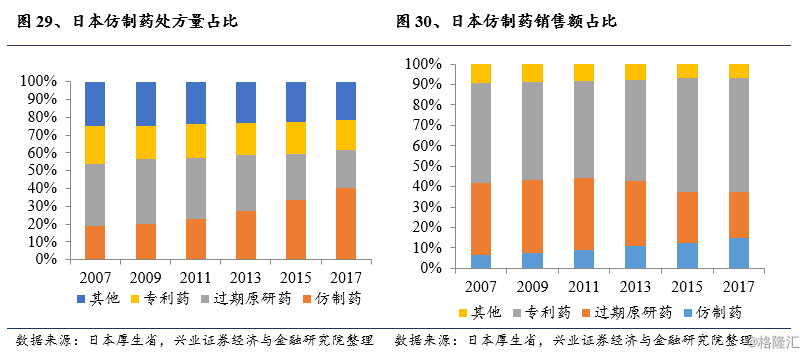
日本医药市场上仿制药占比相对于其他发达国家显著偏低,美国、英国、德国等国家国内仿制药市场占比均在50%以上,而日本在2011年仿制药销售量占比约为22.8%,而销售金额占比仅8.8%;从处方量来看,日本的仿制药处方占比不足20%,远低于其他发达国家。
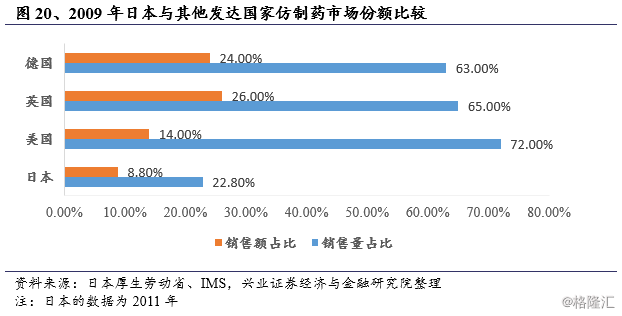
造成这一对比的原因,一方面由于医患长期以来对仿制药缺乏认同,在健全的健保体系下对药品价格并不敏感;另一方面是由于受到日本医保政策中药品定价方式的影响,导致仿制药与原研药之间差价很小,企业缺乏利益驱动。
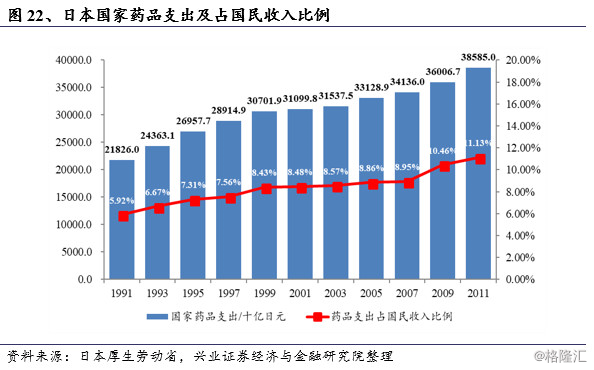
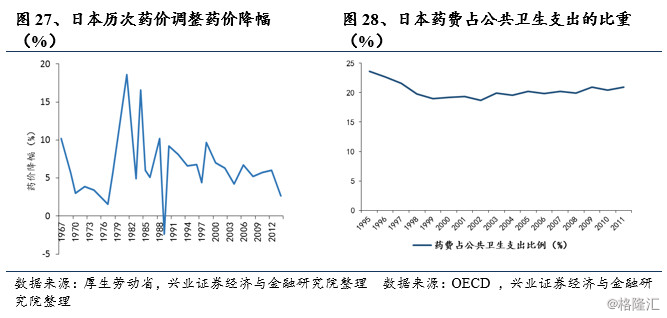
日本全民医保体系的建立和发展对其医药工业产生了极大的推动作用。1961年日本完成“全民皆保险”的覆盖之后,带来了医保费用的巨幅增加和巨大的医疗增量市场。2011财年,医保支出同比增长3.10%至38.5万亿日元,人均医疗支出同比增长3.30%,首次突破30万日元。2011财年日本医疗支出达到国内生产总值(GDP)的8.15%,而占国民收入的比例上升到11.13%。
日本家庭财务负担越来越重,日本政府通过实施一系列措施来应对这种情况,旨在限制卫生支出的持续增加,同时不影响医疗质量。日本厚生省于2007年推出《仿制药安全使用促进行动计划》,其目标是到2013年3月底将仿制药的销量份额提高到30%(旧算法:仿制药在总药物中的占比)。
不幸的是,这个目标没有实现,厚生劳动省的统计数据显示:截至2013年3月31日,仿制药的销量份额约为25.60%。与其他主要国家相比,仿制药在日本市场的份额仍然很低,特别是美国、加拿大、英国和德国,这些国家的仿制药份额已经超过50%。这促使厚生劳动省制定了进一步推广仿制药使用的路线图,该路线图于2013年4月公布,计划到2018年3月底将仿制药的销量份额提高至60%或更高(新算法:仿制药除以仿制药和过期专利药的总和,此处60%相当于旧算法中的34.30%)。
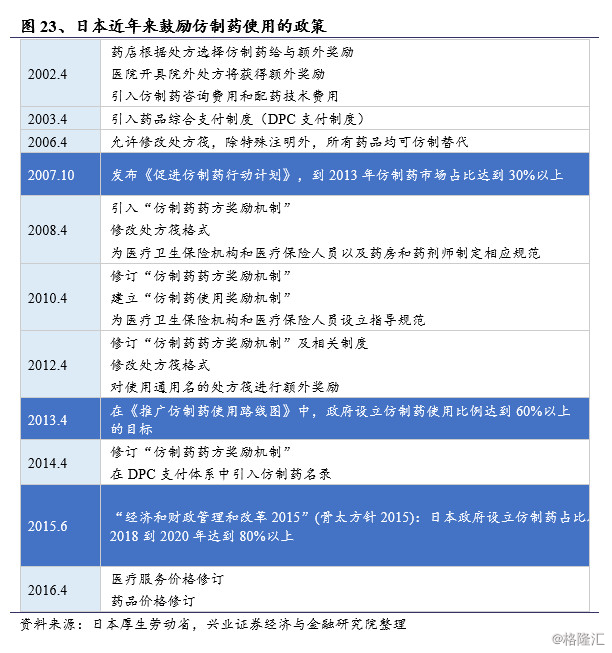
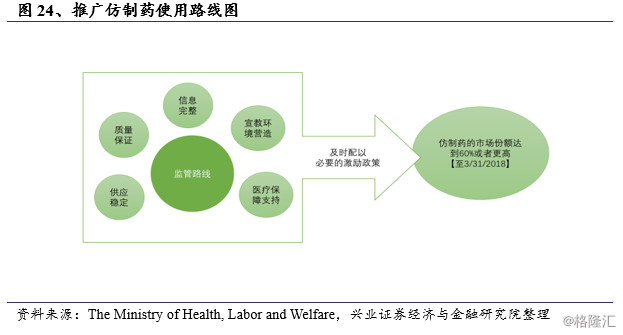
2014年4月,政府出台了一系列措施,以促进仿制药的使用,如“仿制药药方奖励机制”,在DPC体系中引入“仿制药索引”,“建立仿制药使用系统奖励机制”和“通用名处方筏进行额外奖励”,这些激励措施显著提高了医院内部处方筏以及院外处方中仿制药的使用比例。在2015年发布的骨太方针政策中,政府已经提高了仿制药使用比例的目标。
本节小结:日本医药市场仿制药占比相对于其他发达国家显著偏低,造成这一对比的原因,一方面由于医患长期以来对仿制药缺乏认同,在健全的健保体系下对药品价格并不敏感;另一方面是由于受到日本医保政策中药品定价方式的影响,导致仿制药与原研药之间差价很小,企业缺乏利益驱动。2002年开始,日本政府出台了一系列鼓励仿制药使用的政策;2013年,厚生劳动省制定了进一步推广仿制药使用的路线图,计划到2018年3月底将仿制药的销量份额提高至60%或更高。
2.2 日本仿制药定价方式:药品参考价格
日本政府对整个药品市场的价格实行非常严格的管控,为了维持面向1.27亿人口的全民普惠式的医保制度能够正常运转,采取了以药价形成机制为关键突破口的医药卫生费用严格管控。日本药品价格管理是由厚生劳动省医改局负责,政府管理价格的范围涵盖列入医疗保险目录的所有药品,现有15000多种。
日本于1950年开始实施药价基准制度,药价基准制度主要包括两个方面:一是规定了新药与仿制药纳入到药价基准的药价制定方法,包括类似药效比较定价、成本定价和递减定价;二是规定了已收载品的药价调整方式,包括市场价格加权平均调整和药品重新定价等,并最终以药价基准目录的形式将药品的成分、剂型、规格和价格等方面的信息进行呈现,其中价格是指医疗机构和药店销售药品的价格以及医疗保险的药品支付价格。
日本在药品价格管理方面的主要特点就是政府只管制药品零售价格而不管制采购价格。《药事法》规定由政府统一制定药品零售价格政策,不存在地区以及医院药店的价格差异。如此以来医疗机构采购价格越是低于零售价格,其获利越大,然后政府再通过对药品出厂价的检测动态地调整零售价。
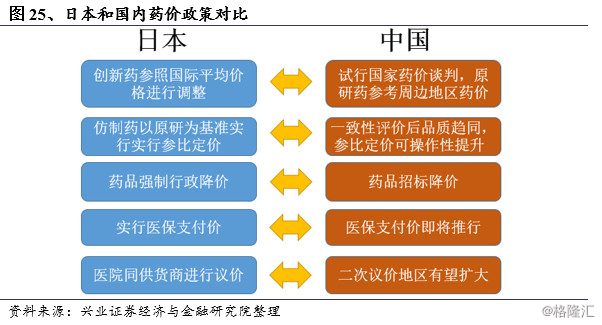
与新药采用根据有无类似品来区别定价的方式不同,日本对仿制药的定价方式是参考原研药品对价格直接进行控制,依据仿制药上市时间先后进行差异定价。第一个上市的仿制药价格为原研药品的0.7倍,日后收载的仿制药其价格为已收录之同规格仿制药品的最低价。1994年开始仿制药收录后,频率为一年一次,自2008开始,频率增加为一年两次。当同规格仿制药品收录超过20项时,其后收录的药品再根据同规格仿制药最低价的0.9倍核算。
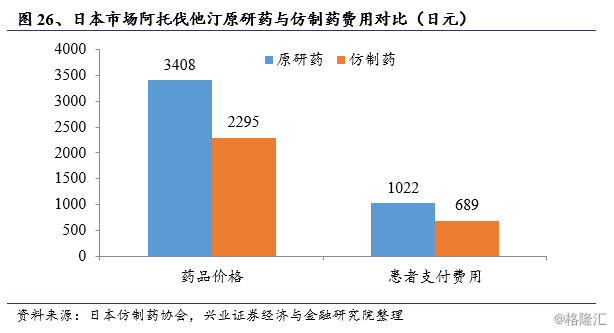
以阿托伐他汀为例,同规格(10mg/天×30天)原研药与仿制药在日本药品名录中价格分别为3408日元与2295日元,患者所需支付费用仅689日元,仿制药的替代可以节约30%的药物开支。
自1992年起,日本政府每2年对药品价格目录中收载药品的实际交易价格进行调查,调查期1个月,调整主要采用两种方式,第一是依据药价调查结果调整,另一种是药价重新核算。
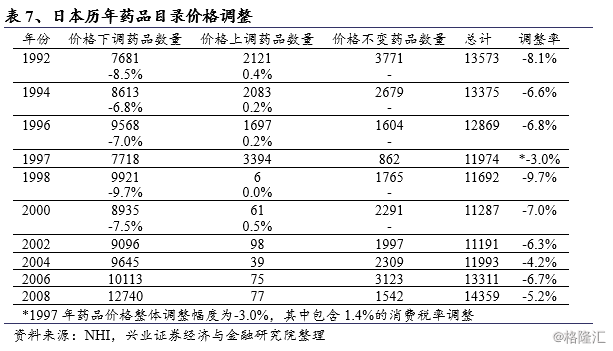
药价调查的目的是为了使药品医保支付价格贴近市场价格,根据市场上产品的加权平均价格,加上一定调整幅度(R-zone)进行药价调整,调整公式如下:
新药价=加权平均价格×(1+消费税)+(旧药价×调整幅度(R-zone)*2%)
R-zone最早设定为15%,为减少批发价格与药品零售价格之差,R-zone逐渐降低,并于2000年规定为2%。原则上药价依照各品牌的市场实际加权平均价进行调整,对于低于原开发厂家20%价格的低价仿制药品,则采用统一成分名称收载,并以该所有品项的分组加权平均价调整。不纳入调整的药品包括:日本药局方收载药品、生物制剂(含血液制剂)、中药、罕见疾病用药、不符合成本药品及低于最低价药品。
日本于2014年开始基于仿制药替代率对原研药价格进行价格调整。该制度规定当第一个仿制药进入市场超过5年后,如果仿制药替代率没有超过60%,则需要降低原研药价格。在药价调整时,首先需根据市场价格加权平均调整方式进行调整,然后对符合下列要求的药品进行降价调整:替代率 <20%,药品价格下降2%;20%≤替代率<40%,药品价格下降 1.75%;40%≤替代率 <60%,药品价格下降 1.5%。在2016年度的药价改革中,新进入医保的仿制药的价格从之前原研药的60%(超过10个品种的内服药是50%)下调到原研药的50%(超过10个品种的内服药是40%)。
本节小结:日本政府对整个药品市场的价格实行非常严格的管控,日本在药品价格管理方面的主要特点就是政府只管制药品零售价格而不管制采购价格。新药采用根据有无类似品来区别定价的方式不同,仿制药的定价方式是参考原研药品对价格直接进行控制,依据仿制药上市时间先后进行差异定价。
2.3 医保支付制度改革对日本仿制药的推动
日本药品的支付制度原则上采用论量计酬方式,支付标准由中央医疗协议会统一制订,2年调整一次。支付标准以点数计算,每点10日元,故申请费用时以点数申请,将药费金额除以10换算为点数。另外,为控制医疗成本,日本独自发展适合日本医疗照护情况的Diagnosis-procedure combination 支付制度 (DPC system),类似美国 DRGs,依据 ICD-10,分成1860类诊断、475 种疾病及16种主要的诊断类别(majordiagnostic categories,MDCs)。2003 年,日本共 82家医院实施 DPC 制度,2004 年有150 家,2005 年增加至有300家医院加入这个制度。这个制度应用于一般病房的住院患者,原则是根据 DPC 分类患者每天的综合费用来支付医疗费用,每家医疗机构分开计算。2003年以前,日本门诊的药品部分负担与药品开立天数及处方笺内含药品种类数有关,分别以内服药及外用药说明如下:
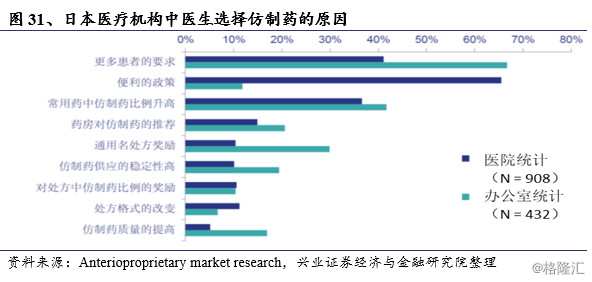
由于日本的医疗费用的支付比率比较一致,门诊和住院服务的自付比率均为30%,小于3岁的幼儿自付比例为20%,70岁以上老年人自付比例为10%,超过一定收入的老年人自付比例为20%。日本在医保支付端的改革主要精力在于处方改革,从2008年开始在处方中增加“可更改为仿制药”的复选框,要求医生仅在不允许选择仿制药时进行署名,明确医生和药剂师的职责,由药剂师确定患者服药史和仿制药使用意向,将仿制药的选择权交给了药店和患者。在药房端,在完成基本供应基础上额外开出仿制药比例22-30%、30-35%、35%以上分别予以5%、15%、19%的额外加成,使得药师行为选择上更倾向于仿制药。于2010年实施医院住院结算时导入仿制药额外加成制度,全面推进仿制药在医保支付端的改革。日本逐年提高医保目录中仿制药的比例,目前日本医保目录中已经超过50%处方药是仿制药。
在日本医药分离的政策背景下,要求医生掌握处方权,专注于医疗服务,药师负责药品的调配管理。医药分离将药店从医院中剥离出来,作为独立的行业进行发展。在政府统一规定药品零售价的政策下,药店的主要经济利益来自于其配药的技术费用与用药咨询费用。许多药店为了招徕更多的患者来自家药店配药,采取独特的周到服务,根据患者个人详细用药史及其支付意愿,为患者提供个性化的用药指导服务,这也在一定程度上提高了仿制药的用药比例。
此外为了防止医生及医疗机构过多用药或用错药,日本进一步推广“固定药店”,鼓励患者尽量在一家最方便的药店固定买药。而药店的专业药剂师会给每位患者建立用药档案,详细记载患者病情、开药医生的姓名及时间。一旦发现用药量异常,药剂师会仔细询问患者的检查数值及原因,不仅实现了对患者用药的系统管理,也是对医生及医疗机构的一种“变相监督”。
本节小结:日本在医保支付端的改革主要精力在于处方改革,从2008年开始在处方中增加“可更改为仿制药”的复选框,要求医生仅在不允许选择仿制药时进行署名,明确医生和药剂师的职责,由药剂师确定患者服药史和仿制药使用意向,将仿制药的选择权交给了药店和患者。在药房端,在完成基本供应基础上额外开出仿制药比例22-30%、30-35%、35%以上分别予以5%、15%、19%的额外加成,使得药师行为选择上更倾向于仿制药。于2010年实施医院住院结算时导入仿制药额外加成制度,全面推进仿制药在医保支付端的改革。日本逐年提高医保目录中仿制药的比例,目前日本医保目录中已经超过50%处方药是仿制药。
2.4 日本版一致性评价助力日本仿制药
随着仿制药获批数量的增长,其品质与原研药的差异(主要是口服固体制剂生物利用度的差异)逐步暴露出来。日本政府借鉴美国FDA进行的药物有效性研究实施项目(DESI),结合日本国内医药行业的实际情况,实行了日本版的仿制药再评价制度。

药品再评价制度分为药效再评价与品质再评价。其中,药效再评价又分为:第一次再评价、第二次再评价和新再评价。日本于1971年开始第一次药品再评价,以1967年9月以前批准上市的药品为对象,共进行了29次,历时17年,评价了约18000个品种,占全部对象品种的98.6%。第二次评价是从1984年始,以1967年10月~1980年3月间批准上市的药品为评价对象。第三次是1998年推出的“药品品质再评价工程”,主要目的是保证不同厂家生产的仿制品均能具有相同的生物等效性,至今完成了约700个化学药。
品质再评价主要针对1995年3月前审批的处方药。因为1994年9月日本颁布《新药品标准及试验方法设定相关指导原则》,其中增加了对片剂等的溶出试验要求。1997年颁布的《仿制药生物等效性试验指导原则》,对溶出试验进行了更加严格、细致的规定。
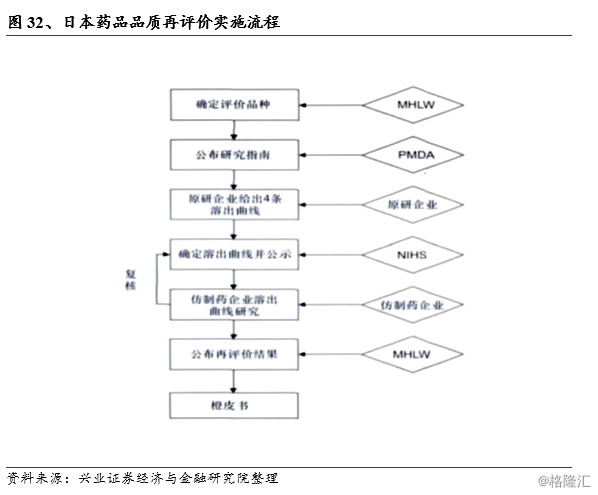
目前日本“药品品质再评价工程”总共评价了700多个化学药(API),1300多个制剂规格,最后批准通过4000多个品目数(批准文号),未通过数目有400多个。通过“药品品质再评价工程”,对体外溶出度的要求更加严格,极大地促进了企业对生产工艺的深入研究,大幅度提高了仿制药品质,同时也促进了日本整个产业链的发展。另外由于“品质再评价工程”是采用药品的多条体外溶出曲线,而不是BE临床实验作为评价的方法,这也为对通过一致性评价并上市的仿制药进行定期治疗核查提供了可能性,对于上市药品的长期质量监管是十分重要的。
经过三次药效再评价以及药品品质再评价的层层筛选,日本医药市场上的仿制药质量大幅提升,为大规模采用仿制药替代昂贵的原研药提供了坚实的基础。根据日本劳动厚生省在发布的《骨太方针2015》中的统计数据,在可以预计的将来仿制药的市场份额会得到显著提升,2015年仿制药数量份额到达56.2%,预计到2020年仿制药数量份额将达80%。
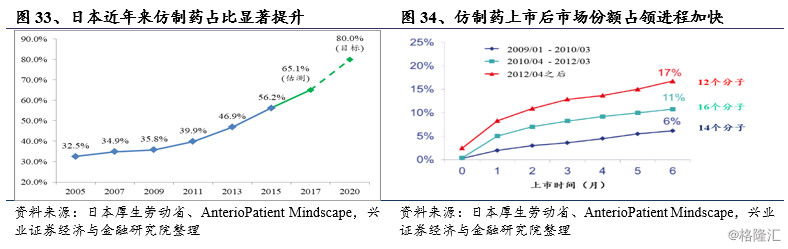
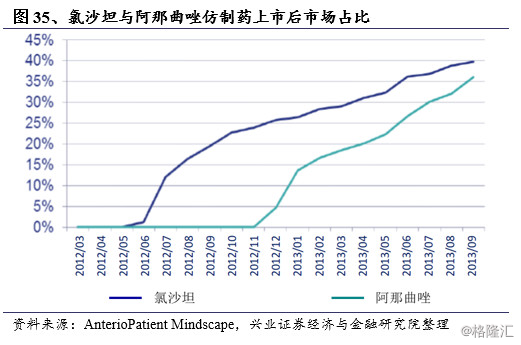
尽管仍然会有部分医患对仿制药的治疗效果存在担忧,但多数医患还是遵照日本厚生劳动省的政策建议,仿制药的使用占比大大提升。重磅抗高血压药物氯沙坦以及抗癌药物阿那曲唑失去专利保护之后,相应仿制药被迅速推向市场,2012-2013年间,这两种药物在上市后1年间的仿制替代率迅速提升到30%左右。
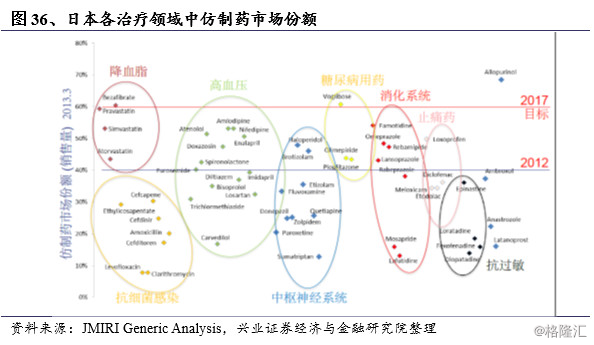
根据药品治疗领域的不同,仿制药对原研产品的替代速度具有相当大的差异。在一些恶性程度不高、慢性疾病或者需要长期服药的治疗领域中,仿制药的替代率远远高出急性、恶性疾病。例如2013年,降血脂、抗高血压、糖尿病及消化系统领域用药的仿制药替代比率远高于抗感染、抗过敏及中枢神经系统用药。
本节小结:为了控制仿制药和原研药的品质差异,日本政府借鉴美国FDA进行的药物有效性研究实施项目(DESI),实行了日本版的仿制药再评价制度。自1971年以来,经过三次药效再评价以及药品品质再评价的层层筛选,日本医药市场上的仿制药质量大幅提升。
 下载格隆汇APP
下载格隆汇APP
 下载诊股宝App
下载诊股宝App
 下载汇路演APP
下载汇路演APP

 社区
社区
 会员
会员



