专注于全球药物研发领域,致力于为药物研发人员、企业、投资者等提供最新、最全面的药物研发信息。通过药融咨询《全球在研新药与靶点月报》,您可以获悉全球范围内的在研新药和靶点信息,了解最新的药物研发进展和趋势,从而更好地把握市场机会和未来发展方向。
据药融云《全球在研新药与靶点月报》数据统计,2023年12月共有210个化药1类新药受理号获CDE承办(含补充申请51个),其中国产131个,进口28个,从申请类型来看,包括临床申请152个,上市申请7个,涉及99个品种,108家企业。
生物药方面,共有113个1类治疗用生物制品受理号获CDE承办(含补充申请31个),其中国产66个,进口16个,从申请类型来看,包括临床申请77个,上市申请5个,涉及92个品种,82家企业。
中药方面,共有5个1类中药受理号获CDE承办,从申请类型来看,包括临床申请2个,上市申请3个,涉及5个品种,5家企业。
2023年12月国内获批临床新药一览表(部分)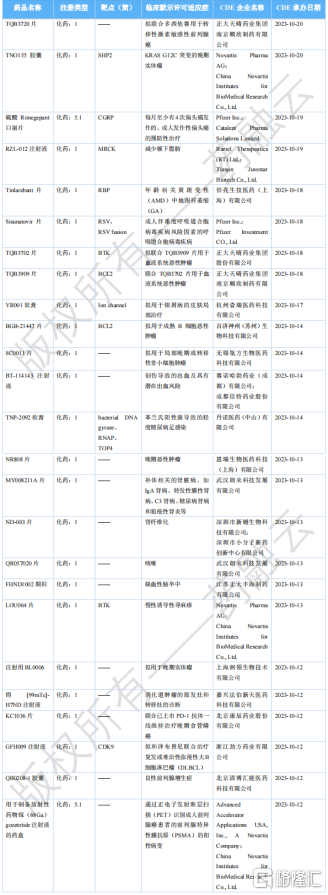
图片来源:药融云《全球在研新药与靶点月报》
12月,国内共有145款新药获批临床(共计230个受理号),其中包括70款化药,73款生物制品,2款中药;其中值得关注的有正大天晴的TQB3720片,百济神州的BGB-21447片,石药集团的SYHX1901片,恒瑞医药的SHR0302缓释片,泽璟制药的ZG005粉针剂,信达生物的IBI343,康缘药业的五味益心颗粒等等。
据药融云数据库统计,12月有4款新药获批上市,分别是默克的盐酸特泊替尼、罗氏的Faricimab注射液、李氏大药厂旗下兆科的首克注利单抗注射液、武田的马立巴韦片。
1.创新药MET抑制剂,国内第5款获批上市
12月8日,国家药品监督管理局发布批准证明文件信息,批准默克申报的5.1类新药盐酸特泊替尼片上市,于治疗携带MET外显子14(METex14)跳跃的非小细胞肺癌(NSCLC)患者。
特泊替尼(Tepotinib,英文商品名:Tepmetko)是一种高选择性口服MET抑制剂,旨在抑制MET基因变异引起的致癌MET受体信号,包括METex14跳跃改变、MET扩增或MET蛋白过表达。
此前,特泊替尼曾获得日本厚生劳动省(MHLW)授予的快速通道资格和孤儿药资格,以及美国FDA授予的突破性疗法认定和优先审评资格。2020年3月,特泊替尼在日本获批上市,2021年2月,FDA加速批准口服特泊替尼上市,也是全球首个获批用于治疗METex14跳跃突变的晚期NSCLC的口服高选择性MET抑制剂。
特泊替尼特殊审批信息查询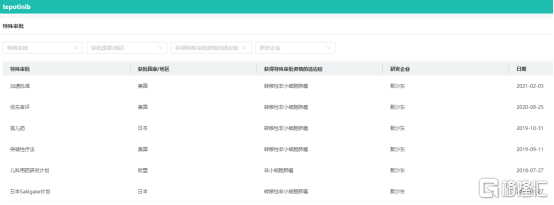
图片来源:药融云全球药物研发数据库
药融云数据库显示,除了默克公司的特泊替尼(Tepotinib),目前国内获批上市的MET抑制剂还有4款,诺华公司的卡马替尼(Capmatinib,商品名:Tabrecta)、和黄医药的赛沃替尼(Savolitinib,商品名:沃瑞沙/ORPATHYS)、海和药物的谷美替尼(商品名:海益坦)、鞍石生物的伯瑞替尼(商品名:万比锐)。
2.罗氏全球首个眼底双抗新药国内获批!
12月18日,NMPA发布药品批准证明文件送达信息显示,批准罗氏的Faricimab注射液上市,用于治疗患有湿性或新生血管性年龄相关性黄斑变性(AMD)和糖尿病性黄斑水肿(DME)的患者。
法瑞西单抗(Faricimab,英文商品名:Vabysmo)注射液是一款靶向Ang-2和VEGF-A的双特异性抗体,同时靶向作用于引起多种视网膜疾病的两条通路——血管生成素-2(Ang-2)和血管内皮生长因子-A(VEGF-A),也是第一个获批用于眼部的一款靶向Ang-2和VEGF-A的双特异性抗体。目前其已在美国、英国等多个国家上市。
VEGF一直以来都是药物研发的热门靶点,尤其在癌症和眼科疾病领域,已然成“兵家必争之地”。目前,全球有多款抗VEGF眼科药物获批上市,包括雷珠单抗(Lucentis)、阿柏西普(Eylea)、布罗鲁珠单抗(Beovu)、康柏西普(Langmu)、法瑞西单抗(Vabysmo)等,涉及双抗、单抗和融合蛋白,以及罗氏、诺华、再生元和辉瑞、康弘生物等生产企业。其中雷珠单抗、康柏西普和阿柏西普在中国获批准上市,并已被纳入国家医保药品目录。
全球VEGF靶点在研新药适应症分布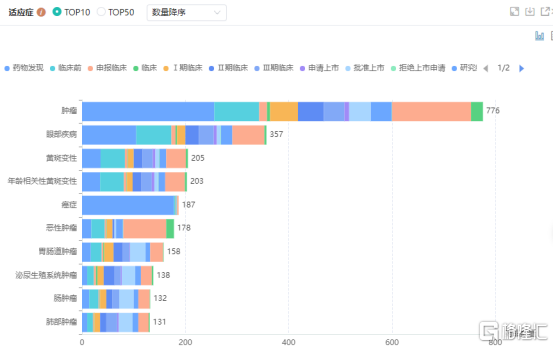
图片来源:药融云全球药物研发数据库
值得一提的是,近日,齐鲁制药的雷珠单抗注射液(商品名:Rimmyrah)获得欧洲药品管理局(EMA)上市批准,国产眼科生物制剂首“出海”,即将进入临床使用,惠及众多患者。
3.兆科PD-L1单抗获批上市
12月21日,NMPA发布药品批准证明文件送达信息显示,批准兆科的首克注利单抗注射液上市。公开资料显示,首克注利单抗是基于Sorrento公司专利G-MAB库平台筛选出的全人抗PD-L1单抗,被李氏大药厂引进,于2021年10月27日获得CDE受理承办,用于治疗复发性或转移性宫颈癌。
首克注利单抗的Ⅰ期+扩展临床研究结果显示,药物安全性良好,大部分药物相关的AE为1到2级,没有发生药物相关的4-5级AE。有效性评价ORR为15.4%,PFS为4.4个月,OS为14.7个月。
首克注利单抗全球临床试验信息查询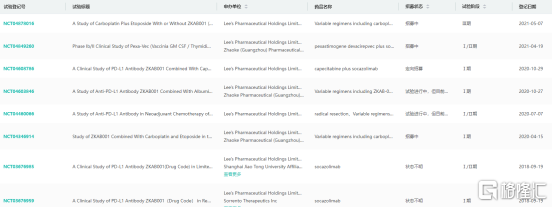
图片来源:药融云全球临床试验数据库
4.武田全新机制抗病毒药物马立巴韦片在华获批
12月21日,NMPA发布药品批准证明文件送达信息显示,批准武田的马立巴韦片上市。马立巴韦片是一款靶向并抑制UL97蛋白激酶及其天然底物的抗病毒制剂,2022年12月20日获得CDE受理承办,2023年2月27日纳入优先审评,用于治疗移植后巨细胞病毒(CMV)感染/疾病,且使用过更昔洛韦、缬更昔洛韦、西多福韦或膦甲酸钠难治(伴或不伴基因型耐药)的成人患者。
马立巴韦片是全球首个且目前唯一一个靶向并抑制UL97蛋白激酶及其天然底物的抗病毒制剂,其获批将为中国难治性CMV感染或疾病的移植受者提供一种全新的口服治疗选择。
 下载格隆汇APP
下载格隆汇APP
 下载诊股宝App
下载诊股宝App
 下载汇路演APP
下载汇路演APP

 社区
社区
 会员
会员



