近日,药融云数据库显示,FDA批准了反义寡核苷酸(ASO)疗法Eplontersen(商品名:Wainua)上市,用于治疗成人遗传性转甲状腺素蛋白(TTR)介导的淀粉样变性的多发性神经病(ATTRv-PN)。
转甲状腺素介导的ATTRv-PN是由衰老或基因突变引起的进行性全身性疾病。ATTRv-PN可在确诊后五年内导致周围神经损伤并伴有运动障碍,若不进行治疗,患者通常在十年内死亡。据估计,全球约有4万例ATTRv-PN患者。
Wainua是首个可通过自动注射器自行给药用于治疗ATTRv-PN的获批药物。该疗法由阿斯利康和Ionis Pharmaceuticals联合研发,可由患者自己皮下注射,每月使用一次。
Eplontersen全球研发进度
 图片来源:药融云全球药物研发数据库
图片来源:药融云全球药物研发数据库
2021年12月29日,Ionis Pharmaceuticals与阿斯利康达成合作,阿斯利康预付2 亿美元,Ionis Pharmaceuticals 授予阿斯利康其配体结合反义 (LICA) 研究药物Eplontersen在美国的商业化权利,以及在世界其他地区的独家权利,Ionis Pharmaceuticals有望获得最高35亿美元的总付款。
药融云数据库显示,2022年1月,Eplontersen在美国被授予孤儿药称号;2023年3月,FDA接受了eplontersen治疗ATTRv-PN的新药申请。
2023年7月10日,Ionis Pharmaceuticals公布了eplontersen的3期研究的最新数据。结果显示,在 85 周内,eplontersen持续阻止神经病变疾病进展,并改善患者的生活质量。
关于ATTR病症
ATTR 蛋白淀粉样变性是由于错误折叠的转甲状腺素蛋白不断积累产生的,是一种典型的医疗需求未被满足的罕见病。ATTR 主要影响神经及心脏功能。根据Intellia 官网2023Q1 Corporate Overview 信息,全球范围内,受遗传性ATTR 困扰的患者规模约50000 人,野生型ATTR 患者20-50万人。
ATTR 伴随心肌疾病患者诊断后的预期生存周期约2-7 年,ATTR 伴随多发性神经疾病患者的预期生存期约10 年。ATTR 可能引起多种不良反应,例如心衰、呼吸困难、虚弱、知觉丧失等,且治疗通常需要延续一生,疾病负担较重。
氯苯唑酸研发状态及特殊审批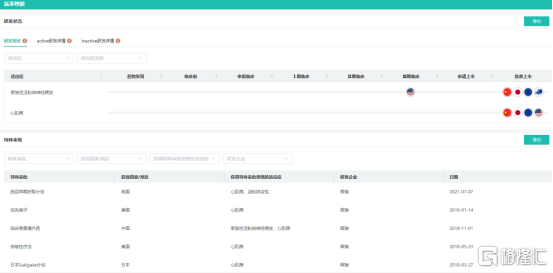
图片来源:药融云全球药物研发数据库
全球对于ATTR 的治疗手段非常匮乏。在2017 年FDA 批准siRNA 药物Patisiran 上市前,几乎没有有效药物,只能通过肝脏移植以及仅在部分国家获批的氯苯唑酸进行治疗。近年来,FDA 陆续批准了Alnylam制药的Onpattro 、Amvuttra,Ionis制药的Tegsedi 、辉瑞的Vyndamax、Vyndaqel 用于ATTR 引起的不同病症。
 下载格隆汇APP
下载格隆汇APP
 下载诊股宝App
下载诊股宝App
 下载汇路演APP
下载汇路演APP

 社区
社区
 会员
会员



