2018年10月1日,本年度诺贝尔生理学或医学奖揭晓并授予两位免疫学家:美国的詹姆斯·艾利森(James P. Allison)与日本的庶佑(Tasuku Honjo),以表彰他们“发现负性免疫调节治疗癌症的疗法方面的贡献”。让我们先恭喜一下伟大的科学家对人类科学进步的贡献!
前段时间,影片《我不是药神》热映并创下30.7亿票房,让更多人对制药公司的“天价药”有了非常形象地认识;而在去年,FDA批准了诺华制药与吉利德旗下的 CART细胞疗法,价格高达四五十万美元;同样引起关注的还有抗高血压药物“缬沙坦”的致癌物杂质风波(一波好多折),以及感冒药扑尔敏原料药一个月涨价58倍的报道(后来又被报道似乎不实??)。上述,只是几个新闻热点,不去展开或更多讨论。
事实上,药品定价高低从来都是一个棘手的问题,也不仅仅与其开发背后漫长过程有关(定价问题也先不讨论);今天本文将简述(真的是简述)药物在研发过程中的成功率到底有多少,且更多是描述药物研发的临床试验 (Clinical Trials) 阶段的成功率,希望能给大家带来一些帮助(//需要更多详细讨论的,以及各阶段药物估值的模型及讨论,可以线下交流//;//需要了解全球更多临床试验相关实验,也有很多公开可以查询的数据库,比如ClinicalTrials.gov,如果你是投资、咨询、科研和相关专业学术等人士,这也是必须需要熟悉的//)。
一、药物研发的概述
很多人常用的“10年10亿美金”来形容创新药的研发时间和成本,但其实有时还会低估其真实的研发成本(国际情况)。权威机构美国塔夫茨大学药物发展研究中心(Tufts Centre for the Study of Drug Development)在2016年研究了10家生物制药公司的106种创新药的研发成本。根据其数据综合预计每种创新药物最终获FDA批准的平均费用约为13.95亿美元,如考虑10.5%的折现率因素,则预计批准的总平均成本或高达25.58亿美元(下图中还补充了其基于1963年到2000年的数据情况,及折现率因素的考量)。PS:Tufts中心在历史上一直有对药物经济学做出很多重要研究。
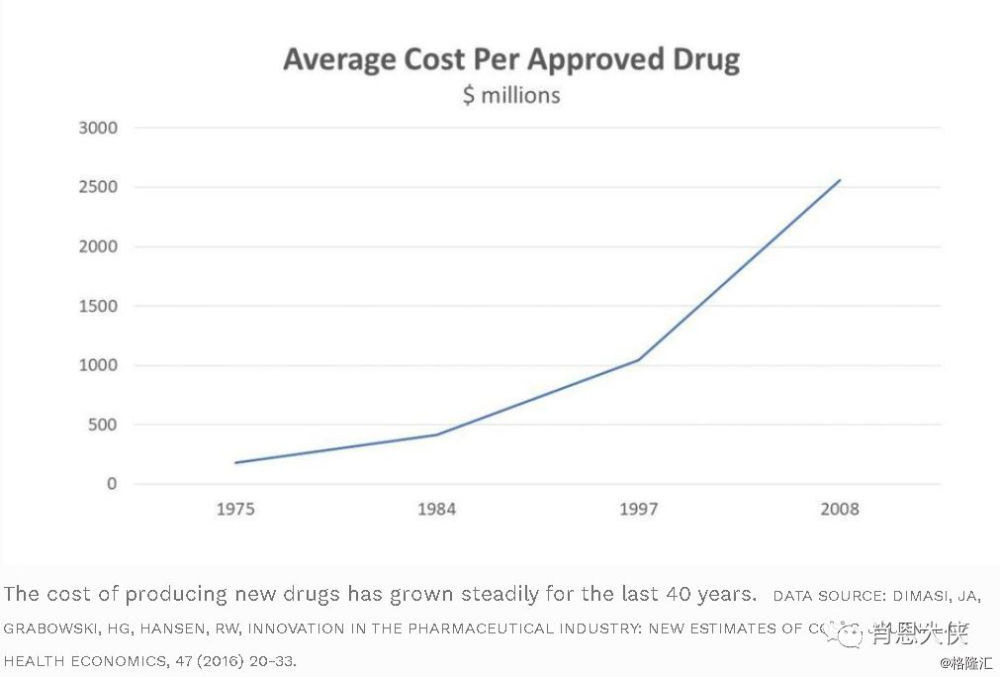
(看大图,需点开)
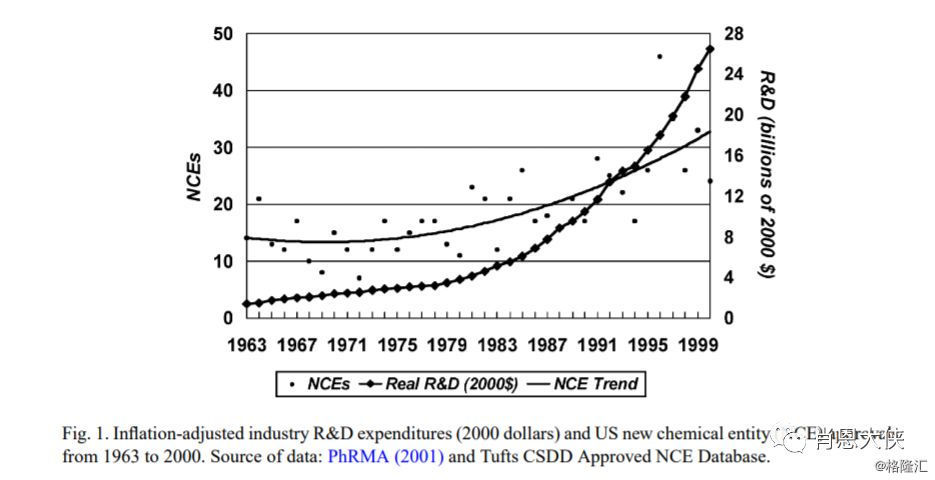
(看大图,需点开)
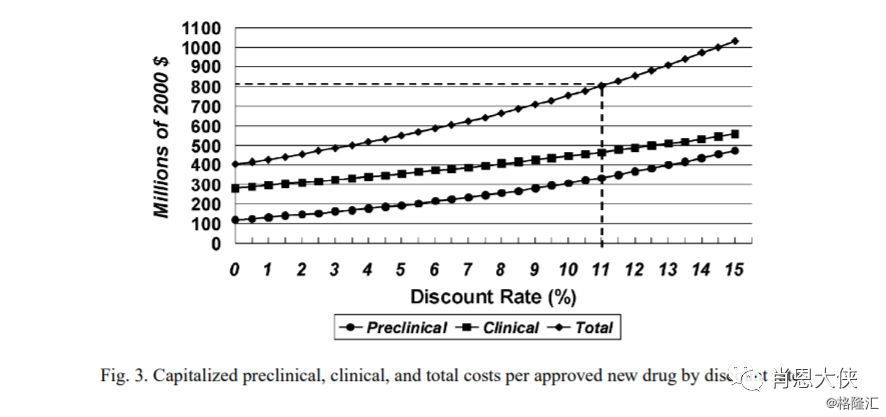
(看大图,需点开)
中国生物制药企业研发投入相对于全世界水平占比较低,其中2016年中国医药研发投入107亿美元,仅占全球医药研发投入的7.4%。不过,值得注意的是通过国家鼓励创新药研发的相关政策,中国医药研发投入占全球的比重从2012年起到2016稳步上升(7.4%),其年复增长率已达到19.2%,远高于全球研发投入的年复增长率(2.4%),而未来政府、研究机构和医药公司等在医药研发的投入上将持续增长。
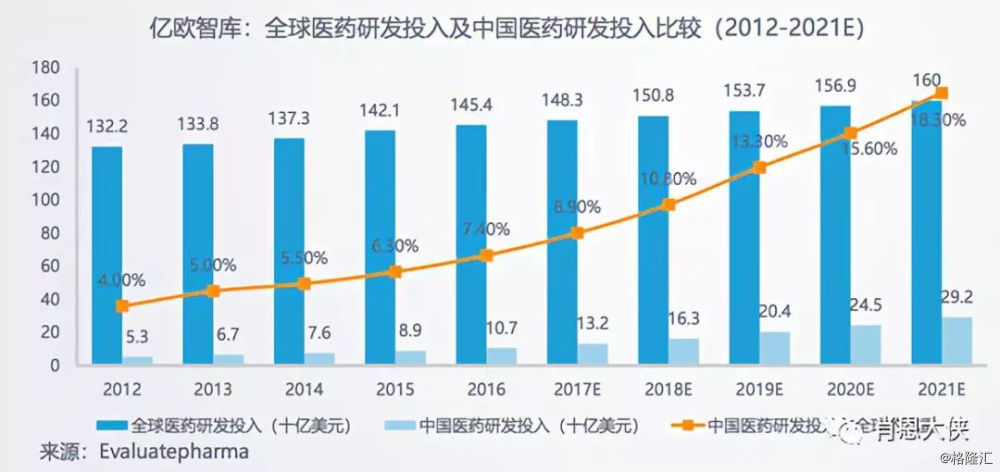
(看大图,需点开)
我们再来看看药物研发的基本流程,创新药物的批准程序包括早期的药物发现 (Drug Discovery) 、对微生物和动物的临床前试验 (Preclinical)、对人类的临床试验 (Clinical Trials)和获得销售该创新药的监管批准 (FDA Review);以下即是FDA对化学创新药物的开发审批流程图。
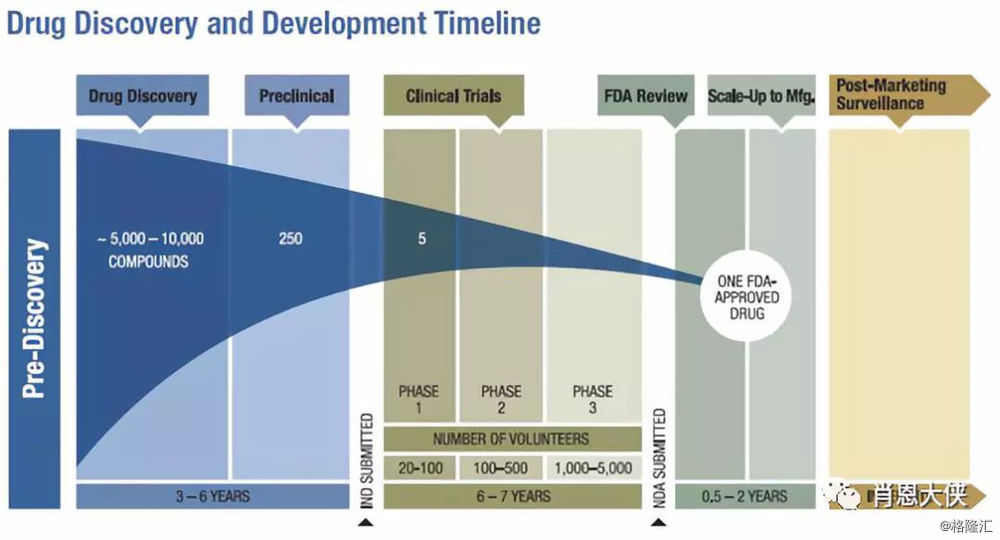
(看大图,需点开)
简单划分,临床试验是整个药物批准程序中最耗时且成本最高的阶段(包括很多投资人也经常问的第一个问题的时候会问,到哪个阶段啦?),其中主要包括临床试验的1-3期。
第一阶段临床试验 (Phase1,I):该阶段通常涉及少数患者(20-80名)并主要关注安全性,潜在的副作用以及药物的吸收、分布、代谢与排泄。
第二阶段临床试验(Phase 2,I/II, II, IIb):如果第一阶段临床试验没有发现药物安全性有问题,可以进行第二阶段临床试验。该阶段涉及上百个患者,其主要目的是通过与对照进行比较来展示药物的有效性。
第三阶段临床试验 (Phase3,II/III, III):如果第二阶段临床试验表明药物对特定人群的病情有效,需要与FDA讨论如何设计第三阶段临床试验从而证明药物批准所需的安全性与有效性。该阶段规模最大,通畅涉及数百上千名患者。第三阶段临床试验除了安全性、有效性数据外还会收集有关适当剂量、与其他药物的相互作用以及对不同人群的影响的信息。
以上,在具体不同的化学药物,或者又如生物药物,有类似又有许多不同之处(先简单理解即可),至于药物上市后的临床四期(上市后),或者国内审批情况,本文不作阐述。
二、《Clinical Development Success Rates 2006-2015》的发现
以下,针对BIO(生物技术创新组织)、Biomedtracker发布的临床试验报告《Clinical Development Success Rates 2005-2016》的部分观点做简要梳理(//需要了解全球更多临床试验相关实验,也有很多公开可以查询的数据库,比如ClinicalTrials.gov,如果你是投资、咨询、科研和相关专业学术等人士,这也是必须需要熟悉的//)。
如果需要了解更多其他数据库,关于数据挖掘的一般框架、方法与技巧也必须需要掌握,比如可参考链接:【PE基本功】形成独立思考之前——搜索技巧
文中数据量和时间跨度:分析了自2006年1月到2015年12月期间9,985次临床阶段过渡 (Phase transition),发生在7,455个药物临床实验项目中,涉及1,103家制药公司。
1、数据选择/分析标准
一些基本的概念、假设和定义:分析期间所有处于终止状态或临床试验阶段的创新药研发项目(涵盖了各大全身主要疾病的药物,样本足够充分);报告仅是考虑了制药公司赞助的FDA-注册药物研发项目;研究中当同种创新药被用于不同疾病时算作两组独立的药物临床试验项目。
临床阶段过渡(自定义)是指退出药物所在阶段,例如从第二阶段临床试验进入到第三阶段临床试验、或在第二阶段临床试验结束后被终止。临床阶段过渡成功率 (Phase transition successrate) 的计算方法是:(进入下一个阶段的药物/(进入下一个阶段的药物+被终止的药物))。NDA/BLA为FDA正在审核药物批准申请; Likelihood of Approval (LOA) 代表从当前临床试验阶段最终获得FDA批准的概率。
2、研究发现
1)、各阶段临床试验过渡成功率与从第一期临床试验获FDA批准的成功率。研究显示平均仅有9.6% (n = 9,985) 进入临床试验的药物能成功获得FDA批准。第一期临床试验过渡成功率 (63.2% n = 3,582) 较高,主要原因是第一期仅关注安全性而不关注有效性。第二期临床试验过渡成功率最低 (30.7% n = 3,862),因为该阶段第一次在患者中测试药物的有效性。耗时最长成本最高的第三期临床试验只有58.1%的过渡成功率 (n = 1,491)。再坚持到FDA审核的药物有85.3%的成功率(n = 1,050)。
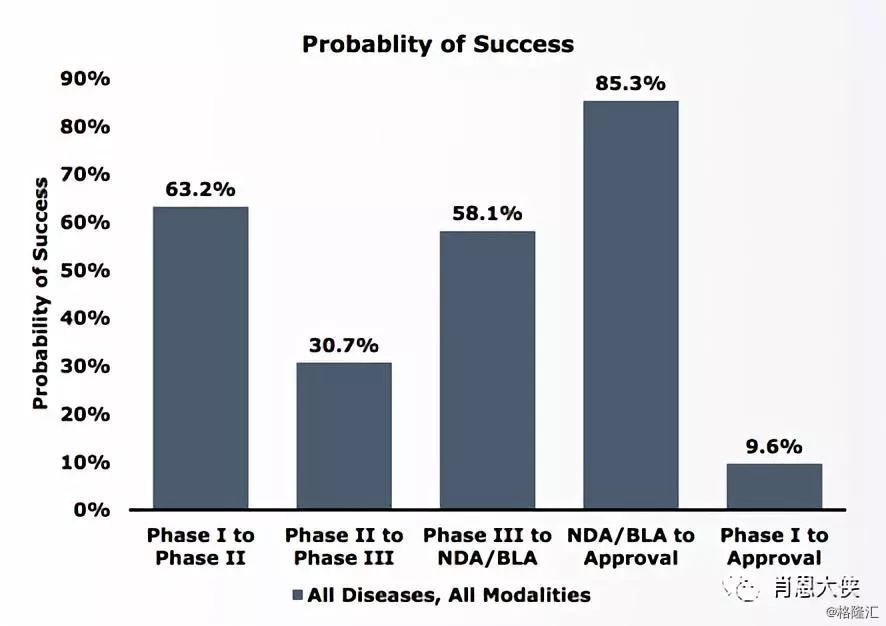
(看大图,需点开)
2)、按疾病细分下的临床试验阶段过渡成功率与LOA。血液病的第一期LOA高达26.1%,远高于平均值,而肿瘤第一期LOA仅有5.1%。神经、心血管、精神和肿瘤第一期LOA都低于平均值,其中神经和肿瘤药物研发基数大 (n = 1,304, n = 3,163),大幅度降低了整体行业的LOA。(下图文字太小,也可自行下载pdf文件阅读)
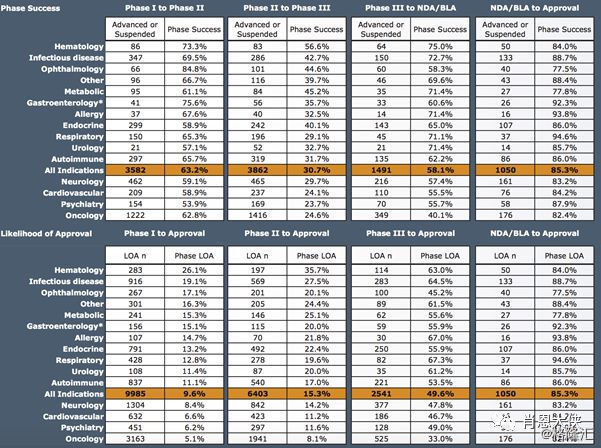 (看大图,需点开)
(看大图,需点开)
3)、 肿瘤与非肿瘤疾病的临床试验阶段过渡成功率与LOA。肿瘤LOA低主要体现在第二期和第三期临床试验过渡率低,其中第三期过渡率比肺肿瘤疾病低23.6% (63.7%到40.1%)。非肿瘤疾病的药物第一期临床试验LOA从9.6%提升到11.9%。
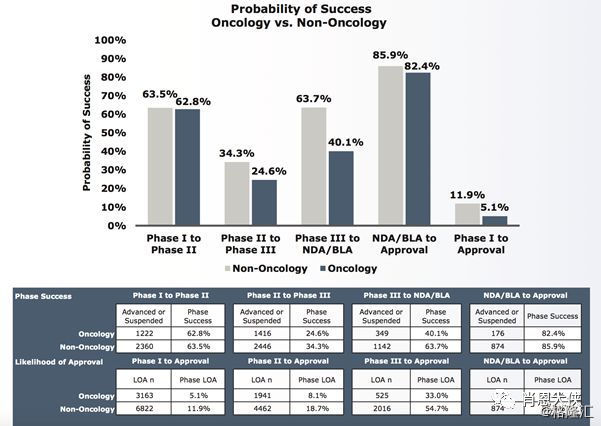
(看大图,需点开)
4)、非肿瘤罕见病与高发慢性疾病临床试验阶段过渡成功率与LOA。罕见病LOA与临床过渡率明显高于平均值,其中整体LOA高达25.3%。罕见病多数由特定基因缺陷致病,治疗中靶点相对明确。高发慢性病LOA与临床过渡率与平均值相似,数据显示研发高发慢性病的成功率远低于罕见病。
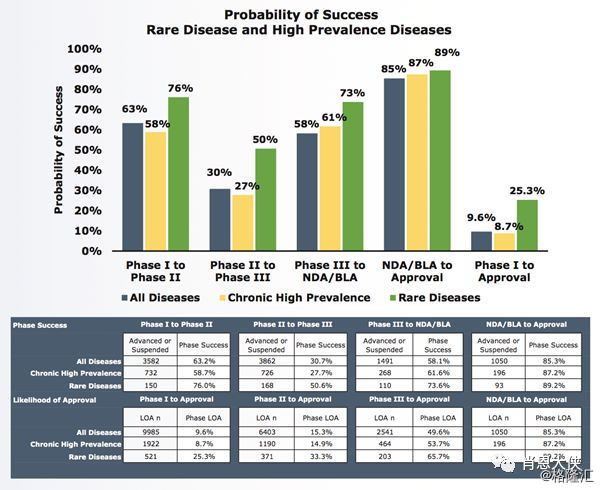
(看大图,需点开)
5)、通过生物标志物筛选患者人群的临床试验阶段过渡率与LOA。运用生物标志物的临床试验个阶段过渡率明显高于不运用的临床试验,其中过渡率最低的二期试验从28%提升到了46%,总体LOA从8.4%提升到了25.9%。
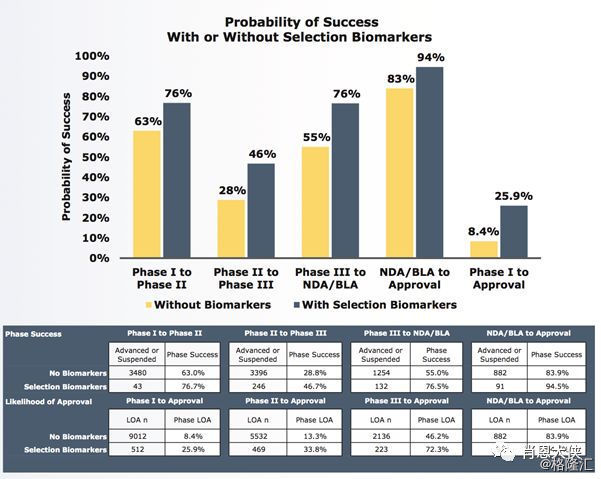
(看大图,需点开)
四、小结、讨论与其他(建议)
一些限制因素:大型制药公司有时不会报道失败的第一期临床试验,因此第一期临床试验过渡率可能偏高。本研究中由于缺乏资源或资金而终止的药物临床试验被视为“暂停”,与因为临床数据较差而终止的项目分在一起。竞争、知识产权诉讼和其他临床数据质量外的市场因素均可能导致临床试验被暂停,其中第二期临床试验过渡率由于第三期临床试验耗时长受影响最大。
一些小结:研究显示平均LOA为9.6%,其中第二期临床试验过渡率明显低于其他阶段。肿瘤LOA明显比平均值低 (5.1%),且基数大,主要体现在第二期、第三期临床试验过渡率低。罕见病LOA明显高于平均值 (25.3%)、高发慢性病LOA (8.7%) 与平均值相似。选择患者群体时使用生物标志物的临床试验中所有阶段过渡率与LOA都有显著的提升,其中总体LOA从8.4%提升到25.9%。
一些讨论:在药物研发的过程中,由于“缺乏资源或资金而终止”的药物临床试验占到了很多,而商业策略的变化、市场因素等也都在调整;单从实验而言,基础科研的进步,临床之前是严重更可预测的动物模型、更早的毒理学评价、生物标志物鉴定和新的技术也可增加药物未来成功的概率;临床试验中利用替代和新颖的替代终点可能也会具有更大灵活性,利用不同的适应性临床试验设计和重新设计(包括利用生物标志物的筛选),改进用于评估患者受益风险的方法,以及改进实验与监管的沟通(这点也非常重要),也都可助于提高成功的概率;从本人自身从事医疗健康投资而言,则鼓励支持更多资本和搭建更有流动、透明及活跃的健康资本市场,也将会使制药公司能够更多开发下一代更好更有效的创新药物。
其他:BIO的报告研究了涵盖的疾病领域包括过敏、自身免疫、心血管、高发慢性病、内分泌、消化内科、神经学、新陈代谢、传染病、血液学、肿瘤、眼科、精神、罕见病、呼吸道与泌尿科;不同疾病领域的药物在不同阶段的成功率分布可参考报告全文。
其他更多关于生物创新药的一些分析,包括宏观、微观政策与资本市场,以及基础研究的很多内容今天并没有讨论详细,也留作未来更多交流吧。
此外:国内的情况,可以参考一下这份报告,很重要,链接如下——药监局2017年度药品审评报告【全文1.2万字】;其他,还有就是2015年以来国际与国内市场发生了太多的变化(包括免疫疗法、其他各种生物治疗等的热点,还尚未来得及整理),对当前创新药投资的几个观点碰撞(欢迎探讨)
文献来源//需要全文,请自行搜索及下载//
(1)Clinical DevelopmentSuccess Rates 2006-2015. BIO, Biomedtracker &Ambion SOURCE
(2)DiMasi, J.A. et al. Innovationin the pharmaceutical industry: New estimates of R&D costs. Journal ofHealth Economics Volume 47, May 2016, Pages 20-33 https://doi.org/10.1016/j.jhealeco.2016.01.012
(3)2018中国医药研发创新 研究报告. 亿欧 https://www.iyiou.com/intelligence/reportPreview?id=84318&&did=550
(4)FDA & Regulatory Policy. Friends ofCancer Research https://www.focr.org/fda-regulatory-policy
 下载格隆汇APP
下载格隆汇APP
 下载诊股宝App
下载诊股宝App
 下载汇路演APP
下载汇路演APP

 社区
社区
 会员
会员



