金斯瑞生物科技(1548.HK)于2018年5月30日晚间公告,Janssen的新药临床试验申请已获得美国食品药品监督管理局的批准。
 早在2017年12月22日,公司与强生(Johnson & Johnson)旗下生物科技公司杨森生物(Janssen Biotech) 签署了关于多发性骨髓瘤领域的若干产品的开发、制造和商业化的特许协议。
早在2017年12月22日,公司与强生(Johnson & Johnson)旗下生物科技公司杨森生物(Janssen Biotech) 签署了关于多发性骨髓瘤领域的若干产品的开发、制造和商业化的特许协议。
当时公司就于Janssen达成共识,对于传奇的CAR-T疗法,传奇已经有若干专利、专有技术及产品相关的其他权利,Janssen将与传奇共同开发、制造、以及全球商业化金斯瑞旗下的CAR-T产品(LCAR-B38M);并共同承担药物研发过程中的开发成本、制造资金开支以及盈亏,大中华区市场,传奇持70%,Janssen持30%,大中华区外两个公司等额分配(50/50)。且传奇和Janssen联合享有技术和专利权,免版权费,向关联公司、顾问及承包商的许可。Janssen会在协议日期后十个工作日内向传奇支付首付款项3.5亿美元,并在里程事件后支付里程碑款。
此次公告显示,Janssen的新药临床试验申请已获得美国FDA的批淮。目前,针对复发/难治型多发性骨髓瘤患者的1B/2期临床项目即将开展,主要是评估JNJ-68284528的安全性及有效性。JNJ-68284528 是基于公司的LCAR-B38M CAR-T技术开发的一种嵌合抗原受体T细胞疗法,1B/2期临床试验是此前与Janssen合作的一部分。
JNJ-68284528是一种以B细胞成熟抗原(BCMA)为靶点的自体CAR-T疗法,BCMA是一种在成熟B淋巴细胞及恶性血浆细胞表面表达的分子。JNJ-68284528药品表达的CAR蛋白与传奇的LCAR-B38M CAR-T产品表达的CAR蛋白完全一致。公司的子公司南京传奇生物科技有限公司目前正在评估用LCAR-B38M CAR-T产品治疗多发性骨髓瘤患者的安全性及有 效 性。评估结果显示,LCAR-B38M CAR-T产品对抑制多发性骨髓瘤具有令人鼓舞的效果,显示了良好的风险效益比率,我们将通过后期 临床试验对此加以确认。
在2017年12月11日,CDE官网显示金斯瑞旗下的南京传奇生物的CAR-T项目提交了临床试验申请,意味着国内首个CAR-T提交了临床试验申请。
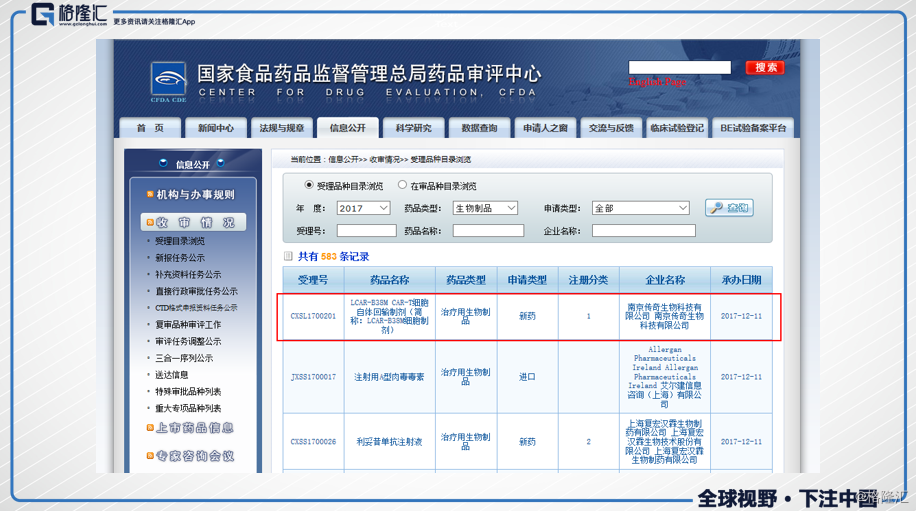 在2018年的3月13日,南京传奇正式收到了国家食品药品监督管理局授出的LCAR-B38M CAR-T用于于自体回输的临床试验批件,南京传奇也开始着手其临床试验。
在2018年的3月13日,南京传奇正式收到了国家食品药品监督管理局授出的LCAR-B38M CAR-T用于于自体回输的临床试验批件,南京传奇也开始着手其临床试验。
南京传奇对CAR-T的研发,最早要回溯到2016年10月28日,公司公告与中国一家3A医院签署了合作协议,治疗19位患有复发难治的多发性骨髓瘤的病人,其中14位已达到”严格完全反应“的诊断标准,4位达到“极好良好部分反应”,剩下一位患者因意外罹患其他疾病,未能进一步参加临床试验。
2017年5月,治疗了35个病人,有效的响应率是100%,35个病人都有相应。完全响应的只有15粒,比例达到43%,非常良好的部分响应是12粒,比例达到34%,部分反映是6粒,比例占到17%,完全响应的比例达到43%,在全球都是不错的比例了。
2017年9月,治疗人数升至71人,40位接受治疗的病人或跟进至少三个月,其中24位病人达到“完全反应”、12位达到“极好良好部分反应”、3位达到“部分反应”、1位未获报告反应。在所有接受治疗的病人中,66位病人曾经历不同程度的细胞因子释放综合症。
小结
公司老三大板块业务都在稳步增长,工业酶业务,因为业务线还在积极拓展当中,今年的增长速度是可以期待的,CAR-T有Janssen的合作支持,项目也在顺利推进中。
 下载格隆汇APP
下载格隆汇APP
 下载诊股宝App
下载诊股宝App
 下载汇路演APP
下载汇路演APP

 社区
社区
 会员
会员


