作者:冬園.伊小磨
先,来一段江湖传说。
“... ... 药物的剂型就像是武林高手行走江湖的兵器,是各门派功夫的具象载体——片剂就像长生剑,未溶解时如剑入鞘,一旦起效锋芒无限,多数人都会用,招式不同而已;注射剂就像七星碧玉刀,刚劲有力,一招制敌;肌肉注射像霸王枪,直来直往,刚猛于枪身,聚千斤之力于枪尖;透气吸收是多情环,虽在体外,却牵一发而动全身,如情难舍;直肠吸收自然是孔雀翎,位置都是一样的,哈哈哈哈哈!(表示”笑“的时候不能用”哈哈“,否则显得不真诚)... ...“
再,来说药物剂型最常见的侠客江湖之皮下制剂。
皮下制剂,为药物剂型的主角,论其为小李飞刀再合适不过!既便于携带,又可预制药品,作用于局部,可替代大刀之勇猛,绝不逊枪王的威力!
一、 常用剂型
1.1 口服给药。口服药的好处在于服用非常方便。通过口腔、食道进入胃,进而消化入血,发挥药效,包括片剂、胶囊、口服液等。片剂、胶囊会在胃内崩解,进一步溶解,随胃液进入小肠,被人体吸收,少数的药品不被吸收,停留在胃、大肠,部分在小肠发挥作用。一般口服药品进入全身的血液循环以前,先经过胃肠道中消化液、粘膜、肝药酶,称“首过效应”。选择此项给药途径要保证药品在该环境不会破坏;有些药物无法经胃肠道吸收,口服后几乎全军覆没,如当前糖尿病患者用的胰岛素只用采取皮下注射方式。
1.2 静脉输液。给药不需要经过口服药物的崩散、溶解、吸收等步骤,可以直接进入血液循环,是所有给药方式中最快产生药效的。如急症病人为了使药效迅速而采取静脉输液。
1.3 肌肉注射。是从肌肉层慢慢进入血液,血管越丰富的部位药物吸收就越快。
1.4 透皮吸收。传统的膏药就是应用透皮吸收的原理,皮肤用制剂主要用于涂敷于皮肤表面,穿透皮肤角质层达到病患部位发挥药效,也有通过皮肤吸收给药以产生全身效应。
1.5 直肠吸收。如肛门栓剂则是从直肠粘膜直接吸收,直肠拉近肛门端的血管极为丰富,一些药剂如栓剂、灌肠剂可以通过直肠吸收进入静脉,对于一些不适合口服,遇到胃酸会分解或有禁忌证的药物可以使用栓剂、灌肠剂给药。
除上述几种给药方式外,药物进入人体的方式还有许多,如直接参与吸收肺部的气雾剂,滴入眼鼻耳的滴眼剂、滴鼻剂、滴耳剂等等。不同剂型的药品会通过各种不同的途经进入人体发挥药效,选择合适的药物型及选择合适的给药方式,可达到临床上满意的效果。
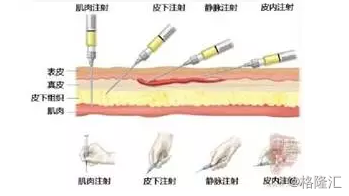
PS:皮下(制剂)注射,指少量的药物注入到皮下组织(表皮与真皮之间)的方法,从皮下脂肪层经毛细血管吸收进入血液,通过血液循环到达淋巴组织,从而产生免疫反应。适合于需要迅速达到药效的药物,不同于口服、静脉注射。针头小、注射器小,通常打在上臂,必要时打在大腿外部和腹部,例如需要终身注射的糖尿病素患。皮下注射一般应用预防过敏的药物试验,预防接种、局部麻醉、胰岛素。
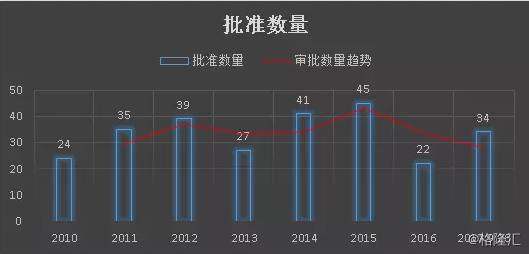
二、2010-2017年FDA批准使用药品
通过对2010年-2017年9月28日FDA审批新药的整理,期间共审批新药267个品种,每年审批数量及趋势如下图:
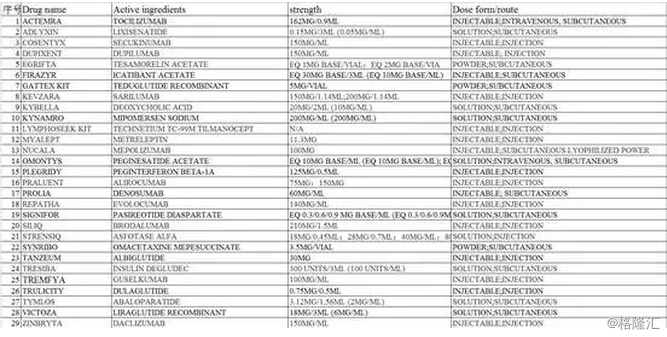
 其中皮下制剂29种,如下表:
其中皮下制剂29种,如下表:
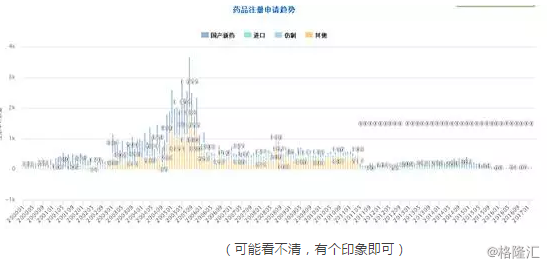
同时,附中国国内药品注册申请过去17年的趋势供参考,只是参考,下图强行插入
好了,回到主题,267个新药品种中29种的皮下制剂按疾病分类,则分布与特点如下:
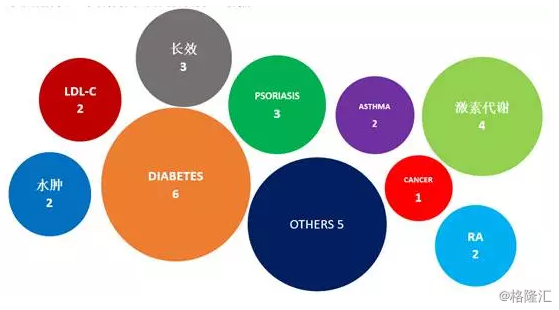
接下来,继续展开。
2.1 RA
Actemra(tocilizumab,托珠单抗)
2010年1月5日,FDA已批准抗炎药Actemra(tocilizumab,托珠单抗)皮下注射制剂,用于巨细胞动脉炎(giantcellarteritis,GCA)治疗。Actemra是首个人源化白细胞介素6受体拮抗剂单克隆抗体,可通过静脉输注(IV)和皮下注射(SC)2种方式给药,该药已获全球多个国家批准用于中度至重度活动性类风湿性关节炎(RA)成人患者的治疗。
Kevzara(sarilumab)
2017年5月23日法国制药巨头赛诺菲(Sanofi)与合作伙伴再生元(Regeneron)合作开发的抗炎新药Kevzara(sarilumab)获得FDA批准,用于既往接受一种或多种生物类或非生物类疾病修饰抗风湿药物(DMARDs)治疗缓解不足或不耐受的中度至重度活动性类风湿性关节炎(RA)成人患者。Kevzara需要联合甲氨蝶呤(MTX)或其他传统的DMARDs药物联合用药;若患者对甲氨蝶呤或DMARDs不耐受或有禁忌时,Kevzara也可单独用药。去年底公布的III期临床研究SARIL-RA-MONARCH的数据显示,对甲氨蝶呤治疗缓解不足或不耐受或不适用的活动性类风湿性关节炎(RA)成人患者群体中,与艾伯维重磅抗炎药修美乐(Humira,通用名:adalimumab,阿达木单抗)相比,sarilumab在改善临床症状和体征方面具有优越性,数据具有统计学显著差异。
2.2 激素代谢
Prolia(denosumab,狄诺塞麦)
2010年6月1日,安进(Amgen)用于预防绝经期后的妇女骨折的生物制剂Prolia获批。FDA的批准比安进的预期提前了两个月,它被视为安进未来最重要的产品。根据美国国立关节炎、肌肉骨骼和皮肤病研究所资料,每2位50岁以上的美国妇女中,有一位会因骨质疏松发生骨折。FDA称Prolia为易发生骨折的患有骨质疏松症的绝经期后妇女提供了一种治疗选择。
Tymlos(ABALOPARATIDE)
美国 FDA 宣布批准 Radius 保健公司药物 Tymlos 用于治疗骨质疏松症,适用于处于骨折风险或对其它治疗药物无效的绝经后妇女。该药物通过注射使用,其在临床试验中与安慰剂相比,显示可以使脊柱骨折的绝对风险降低 3.6%,使非脊柱骨折风险降低 2%。该药物的获批时间早于预期,其上市后将与礼来的 Forteo(特立帕肽)及安进的 Prolia(狄诺塞麦)相竞争。
SIGNIFOR (Pasireotide,帕瑞肽)
环己肽生长抑素类似物,用于治疗手术无效的库欣病(Cushing’s disease)。Cushing’s disease是垂体ACTH腺瘤或ACTH细胞增生,分泌过多ACTH,引起肾上腺皮质增生,产生皮质醇增多症,导致一系列物质代谢紊乱和病理变化。Pasireotide抑制ACTH分泌,从而减少皮质醇的分泌。
Myalept(注射用美曲普汀)
2014年2月24日,美国FDA批准Myalept(注射用美曲普汀)作为替代治疗药物结合饮食用于治疗先天性或获得性全身脂肪代谢障碍患者的瘦素缺乏并发症。全身脂肪代谢障碍是一种与脂肪组织缺乏有关的病症。先天性全身脂肪代谢障碍患者出生时很少或根本没有脂肪组织。获得性全身脂肪代谢障碍患者通常随着时间的推移失去脂肪组织。因瘦素在脂肪组织制造,所以全身脂肪代谢障碍患者的瘦素水平很低。瘦素调节进食及其它激素,如胰岛素。

2.3 Diabetes
Victoza(利拉鲁肽)
Victoza适用于饮食控制和运动加上最大耐受剂量二甲双胍仍不能达到理想血糖控制的II型糖尿病成人患者,可与二甲双胍联用以改善血糖控制,每日注射一次。Victoza适用于饮食控制和运动加上最大耐受剂量二甲双胍仍不能达到理想血糖控制的II型糖尿病成人患者,Victoza不应用于此前称为非胰岛素依赖的I型糖尿病。

GATTEX KIT(Teduglutide,替度鲁肽)
胰高血糖素样肽-2类似物,用于治疗短肠综合征(Short Bowel Syndrome)。短肠综合征是指由于严重小肠疾病或外科手术切除大部分小肠导致机体无法正常吸收营养的而引发一系列综合征,多数患者只能依靠全部或部分胃肠外营养(静脉途径)供给获得机体所需的营养成分。但胃肠外营养不仅严重影响患者生存质量,而且还常发生严重并发症,如静脉通道引起的感染、小肠内细菌过度增殖、肝毒性以及胆道疾病。此前FDA批准的用于治疗SBS药物有Zorbtive(重组人生长激素,2003年)、NutreStore(左旋谷酰胺,2004年)。
Tanzeum(阿必鲁泰[albiglutide]
TANZEUM是一种GLP-1受体激动剂适用为一种对饮食和锻炼辅助在有2型糖尿病成年中改善血糖控制。对饮食和锻炼控制不佳患者不建议作为一线治疗。尚未在有胰腺炎患者中研究。在有胰腺炎史患者考虑其他糖尿病治疗方法。每周1次皮下注射剂阿必鲁泰,结合饮食和锻炼,可改善2型糖尿病患者的血糖控制情况。

Trulicity(Dulaglutide)
2014年礼来制药针对用于2型糖尿病治疗的每周一次的dulaglutide(在研的长效胰高血糖素样肽1(GLP-1)受体激动剂)获批。在AWARD-6研究中,每周一次的dulaglutide 1.5 mg达到主要研究终点,即非劣效于每日一次的liraglutide 1.8mg,评估指标为从基线至26周的糖化血红蛋白(HbA1c)的降幅。

Tresiba(德谷胰岛素注射剂)
2015年9月25日,诺和诺德的糖尿病药物Tresiba和 Ryzodeg最终获得了FDA的批准,这进一步巩固了诺和诺德作为糖尿病治疗巨头的地位。长效胰岛素Tresiba(德谷胰岛素)和复方药Ryzodeg(德谷胰岛素和门冬胰岛素)将有可能与赛诺菲的Lantus(甘精胰岛素)展开激烈的市场争夺战,而Lantus是一款年收益70亿美元的重磅糖尿病药物。根据预测,Tresiba的销售额预计高达30亿美元。
Adlyxin (lixisenatide)
Adlyxin是胰高血糖素样肽-1(GLP-1)受体激动剂,具有促进胰岛素分泌和合成、抑制用餐后胰高血糖素释放、延缓胃排空、改善β细胞功能并阻止其凋亡等多重作用而发挥出广泛的降糖作用。
2.4 长效——聚乙二醇类
OMONTYS(Peginesatide)
促红细胞生成剂,用于治疗接受透析的慢性肾脏病(Chronic Kidney Disease)患者的贫血。Peginesatide是一种聚乙二醇肽,可结合并刺激人类促红细胞生成素受体,通过增加血红蛋白,从而升高网织红细胞计数,达到改善贫血的目的。早在1989年,Amgen公司第一个基因重组药物Epogen(促红细胞生成素)获得FDA的批准,用于各种贫血的治疗,2003年销售额达24.4亿美元。之后,Amgen公司第二代促红细胞生成素Arnesp、Johnson &Johnson的Procrit/Eprex均取得巨大成功。Peginesatide的优势在于,患者只需每月注射一次,而Epogen则需每月注射12次。
Plegridy(聚乙二醇化干扰素β-1a)
2014年8月16日百健艾迪(Biogen Idec),FDA批准多发性硬化症药物Plegridy(聚乙二醇化干扰素β-1a),用于复发-缓解型多发性硬化症(RRMS)成人患者的治疗,RRMS是多发性硬化症(MS)的最常见类型。Plegridy通过注射笔(Plegridy Pen)皮下注射给药,每2周1次。Plegridy Pen是一种新的预充式即用型自动注射笔。Plegridy是唯一一种获批用于复发缓解型多发性硬化症(RRMS)的聚乙二醇化干扰素,已被证明能够显著减轻疾病的活动,包括复发次数、核磁共振脑部病变及残疾进展。
Plegridy(聚乙二醇干扰素[peginterferon] beta-1a)
PLEGRIDY是一种干扰素β适用为多发性硬化症复发型病人的治疗,只为皮下注射每14天125 µg (2.1) 预充填笔或注射器自身皮下注射给药。复发-缓解型多发性硬化症(RRMS)是多发性硬化症(MS)的最常见类型。近30年来,在多发性硬化症(MS)药物开发领域,百健艾迪一直处于领先地位,其强大的药物组合及在研的其他药物,能够从最早迹象的出现至病情晚期,帮助管理MS疾病。
2.5 Cancer
SYNRIBO(Omacetaxine Mepesuccinate)
2012年Teva Pharmaceuticals公司高三尖杉酯碱获得FDA批准上市。高三尖杉酯碱,天然产物,用于治疗慢性粒细胞白血病(Chronic Myelogenous Leukemia)。在酪氨酸激酶抑制剂(伊马替尼、达沙替尼、尼洛替尼、博舒替尼)治疗无效时,可使用高三尖杉酯碱治疗。
2.6 Asthma
Nucala(mepolizumab)
2015年11月4日,FDA批准了葛兰素史克(GSK)治疗严重哮喘的抗体——美泊利单抗(Mepolizumab)商业上称为Nucala,被批准可用于12岁以上患者的附加维持治疗,可每四周注射一次。该药物预期销售额为6到10亿美元。
Dupixent(dupilumab)
美国FDA已批准法国制药巨头赛诺菲(Sanofi)与再生元(Regeneron)合作开发的 Dupixent(dupilumab)注射液用于外用处方药无法充分控制病情或不适合这些药物治疗的中度至重度特应性皮炎(AD)成人患者。预计该药的年销售峰值将突破28亿美元。Dupixent是一种皮下注射药物,每隔一周皮下注射一次,可单独用药,也可与外用皮质类固醇联合用药。中重度特应性皮炎(AD)是一种严重的慢性炎症性皮肤病,主要表现为剧烈的瘙痒、明显的湿疹样变和皮肤干燥。特应性皮炎(AD)常常自婴幼儿发病,部分患者延续终生,可因慢性复发性湿疹样皮疹、严重瘙痒、睡眠缺失、饮食限制以及心理社会影响而严重影响患者的生活质量。Dupixent(dupilumab)是一种全人源化单克隆抗体,特异性抑制2种关键蛋白IL-4和IL-13的过度激活信号。IL-4/IL-13是2种炎症因子,据认为是特异性皮炎(AD)持续内在炎症的关键驱动因素。
2.7 Reduce low density lipoprotein-cholesterol (LDL-C)
Kynamro(MIPOMERSEN SODIUM,米泊美生钠注射液)
2013年1月29日,米泊美生(mipomersen)是 Genzyme 研发的一种合成的硫代磷酸寡核苷酸,被 FDA 批准用于治疗纯合子型家族性高胆固醇血症(homozygous familial hypercholesterolemia,FoFH)。作为反义核酸类药物,米泊美生通过与 Apo B-100 蛋白 mRNA 的编码区互补配对,抑制 Apo B-100 蛋白(LDL 和 VLDL 的主要载脂蛋白)的翻译合成,降低 FoFH 患者的 LDL-C、TC、Non-HDL-C 水平。在为期 26 周涉及 56 名 FoFH 的多国随机对照试验中,治疗组平均 LDL-C、TC、Apo B、Non-HDL-C、TG 水平分别降低 25、21、27、25、18 mg/dL,平均 HDL-C 水平增加 15,而安慰剂组各项指标变化均在 5 mg/dL 以内。值得注意的是,该药说明书中有一黑框警告,须警惕肝毒性。
Repatha(evolocumab)/Praluent(alirocumab)
2015年8月24日安进(Amgen)研发的PCSK9抑制剂Repatha(evolocumab)获得FDA批准,标志着全球首个新一代PCSK9抑制剂类降脂药成功诞生!赛诺菲的PCSK9抑制剂Praluent于7月24日获得FDA批准,成为美国市场中首个新一代PCSK9抑制剂类降脂药。PCSK9抑制剂是一类单抗药物,靶标是一种名为前蛋白转化酶枯草溶菌素9(PCSK9)的蛋白,该蛋白可降低肝脏从血液中清除低密度脂蛋白胆固醇(LDL-C)的能力,而LDL-C被公认为心血管疾病(CVD)的主要风险因子。PCSK9抑制剂提供了一种全新的治疗模式来对抗LDL-C,被视为他汀类(如Lipitor和Zocor)之后降脂领域取得的最大进步。
2.8 PSORIASIS
Siliq (brodalumab)
2017年2月15日,FDA批准Siliq (brodalumab)注射剂用于治疗对其他系统性治疗不响应的成年中重度斑块状银屑病患者。FDA在审核了Siliq的三期临床数据后,表示Siliq可以帮助相当数量的中重度斑块状银屑病患者临床受益,实现总体清除。在涉及2400名病人的两个重复比较试验中,210mg剂量组Siliq的受试病人,达到总体清除的患者人数约为ustekinumab受试组的两倍。Siliq为阿斯利康与Valeant公司合作开发的产品。根据合作协议,阿斯利康给予Valeant在除欧洲、日本及某些亚洲国家外的全球开发和销售Siliq的独家授权。同时,两家公司将分享Siliq在美国市场的销售利润。此外,在获得FDA首次批准后,阿斯利康将获得Valeant的1.3亿美元的里程碑金。SILIQ通过皮下注射给予,在0、1、2周210mg,接着每两周210mg。
TREMFYA(guselkumab)
TREMFYA治疗患有中度至重度斑块性银屑病,这些成年患者可适用于全身性治疗或光疗。TREMFYA是第一款,也是唯一获得批准的选择性靶向阻断细胞因子IL-23的生物制剂疗法(biologic therapy),这类细胞因子在斑块性银屑病的发病中起关键作用。第0周和第4周接受两次起始剂量后,患者每8周进行100mg剂量TREMFYA的皮下注射。
Cosentyx®(secukinumab,苏金单抗)
2016年1月15日,诺华宣布(FDA)已批准将Cosentyx®(secukinumab)(苏金单抗) 用于治疗两种新的适应证——患有活动性强直性脊柱炎(AS)和活动性银屑病关节炎(PsA)的成年患者。AS和PsA都是会持续终生的炎症性疾病,会造成疼痛、损害关节和/或脊柱,使患者日渐衰弱。Cosentyx是白细胞介素-17A(IL-17A)抑制剂中第一个上市的药物,能同时治疗AS和PsA。在这两种新的适应证获批之前,FDA已于 2015年1月批准Cosentyx用于中重度斑块状银屑病成年患者,而欧洲也已于2015年11月批准将其用于AS和PsA的治疗。
2.9 水肿
Firazyr (icatibant,艾替班特)
在被FDA拒绝了3年之后,Shire终于在去年春天听到了Firazyr获批的消息。之前,FDA的一个专家小组以12-1的投票结果推荐该药物用于18岁及以上患者遗传性血管水肿的急性发作。该小组还表示,患者应该可以自己服用这个药物。虽然遗传性血管水肿是罕见病,但是分析师们预测Firazyr的年销售峰值有可能会超过1亿美元。Firazyr已经在欧洲获批。

Haegarda
2017年06月27日美国FDA批准首个皮下注射型C1酯酶抑制剂用于遗传性血管性水肿(Hereditary angioedema HAE),这是一种遗传性疾病,全世界范围内每1万人至5万人里就有1人患有这种罕见遗传病,他们需要一种能改善生活质量的有效疗法。由CSL Behring带来的Haegarda是一款从人类的血浆中获取,并经过了纯化、巴氏法消毒、冻干制备的C1酯酶抑制剂。这也是首款获批的皮下注射型C1酯酶抑制剂(C1 esterase inhibitor,C1-INH)。
2.10 Others
Kybella(去氧胆酸)——全球首个“双下巴”溶脂针
2015年4月29日,Kybella(deoxycholic acid)是一种溶细胞药物,注入体内组织后破坏细胞膜导致细胞溶解,用于治疗成人中至重度颌下脂肪。这是FDA批准的全球首个“双下巴”溶脂针Kybella(ATX-101),用于中度至重度“双下巴”成人,该针剂是用于消除多余颏下脂肪(双下巴)的首个也是唯一一个非手术治疗产品。ATX-101是一种人造的脱氧胆酸(deoxycholic acid),这是人体内天然存在的一种物质,帮助分解脂肪。预期销售峰值为3亿美元。
Zinbryta(daclizumab)
2016年5 月 27 日,美国 FDA 批准,用于复发性多发性硬化成年患者治疗。Zinbryta 是一种长效注射剂,其每月可由患者自行使用。多发性硬化是中枢神经系统的一种慢性、炎症性自体免疫疾病,它可破坏大脑与人体其它部位之间的联系。该疾病是青少年中神经疾病的最常见因素之一,女性的发病率高于男性。对于大多数多发性硬化患者,功能恶化的发作(复发性)最初伴有恢复期(缓解)。随着时间的推移,功能恢复可能变得不完全,导致功能逐渐下降,残疾程度增加。
Strensiq(asfotase alfa)
2015年10月26日,美国罕见血液病药物生产商Alexion花费10.8亿美元收购的药企Enobian终于“物有所值”,FDA宣布Alexion的asfotase alfa(将以商品名Strensiq销售)获批,该药物用于治疗一种罕见的代谢性疾病——低磷酸酯酶症(HPP)。作为罕见病药物市场的先驱,Alexion曾花费6.1亿美元预付款收购Enobia ,并且在2012年得到该药物。Strensiq获批意味着低磷酸酯酶症患者这一群体将首次有药可医。Strensiq获批是一个非常典型的例子,说明突破性疗法认定是如何为罕见病患者带来全新的、满足需求的治疗方式的。
Lymphoseek:technetium Tc 99m tilmanocept注射剂
Lymphoseek是一种新型放射诊断试剂,也是30年来FDA首次批准用于淋巴结定位的新药。该药是一种合成的大分子,含有多个甘露糖和二乙烯三胺五醋酸片段,甘露糖可以识别甘露糖受体,起定位作用,二乙烯三胺五醋酸可以螯合99mTc,起放射显影作用。该药通过淋巴网状内皮细胞表面甘露糖受体(CD206)特异性结合,精确定位原发肿瘤发生转移的前哨淋巴结(sentinel lymph node,SLN)。两项临床试验对比了Lymphoseek和上市药物blue dye,共332名恶性黑素瘤或乳腺癌患者参与研究,均注射Lymphoseek和blue dye,结果显示两种药物都定位了大部分淋巴结,但有29%-30%的乳腺癌患者、38%-41%的恶性黑素瘤患者的淋巴结仅被Lymphoseek定位。
Egrifta
Egrifta用于治疗艾滋病患者肝脏、腹部及腹部内脏器官等的脂肪代谢障碍问题。Egrifta是一种生长素释放因子(GRF)药物, 每天只能注射一次。使用该药产生的不良影响有:关节痛、注射部位皮肤发红、胃痛、肿胀、肌肉疼痛等。该产品由位于加拿大蒙特利尔的Tthera technologies公司研发,由Rockland, Mass, based EMD Serono在美国上市。
三、其他著名皮下制剂药物
3.1 大名鼎鼎的赫赛汀
完成对基因泰克公司的收购以后,罗氏似乎已经将注意力转向如何解决上述问题及提高制备单抗药物产能方面。罗氏公司投资约1.81亿美元(1.9亿瑞士法郎)改进生产设施,用于开发药物输送装置和平台技术,从而使皮下注射成为自我管理生物抗癌药物的给药手段。2006年就支付给Halozyme治疗公司首付款2000万美元,并同意支付6.81亿美元,分5期支付相关的里程碑费用,以获得该公司涉及药物输送技术的全球权利。
一般情况下,单抗药物治疗每次需要注射的抗体蛋白剂量大约在100毫克~1克之间。由于制备单克隆抗体药物的高浓度制剂是50毫克范围/毫升,每次治疗通常需要通过静脉输液,给病人注射2~20毫升的药物,而且必须在医院和诊所中由专业护士负责注射。在乳腺癌的治疗上,赫赛汀一年的治疗费用超过3.8万美元。赫赛汀药物标记黑框上所标明的警告部分与给药方式有关,即“可能导致输液反应,包括过敏反应、血管水肿、急性呼吸窘迫综合症。”
赫赛汀的皮下注射给药途径通过开展临床Ⅲ期研究,证明皮下注射赫赛汀既能为治疗过程提供方便,又能避免或减少与注射相关的反应。这种新制剂的剂型开发需要借助Halozyme公司的Enhanze技术。在注射单抗药物的同时,联合注射rHUPH20可以允许最多5倍以上的剂量,通过皮下注射,原来5~10毫升的注射量可以改为1~2毫升。这就使原先必须用静脉注射的给药方式转换为更加理想的给药途径,使得皮下注射有可能成为慢性疾病患者自我管理的给药方式。除此之外,由于病人自我管理给药,可以避免病人每次前往输液中心的麻烦,而患者在输液中心的等待会加重他们的焦虑。
3.2 醋酸亮丙瑞林
醋酸亮丙瑞林为促性腺激素释放激素激动剂,适用于晚期前列腺癌(D2期)的姑息治疗。Eligard是醋酸亮丙瑞林的缓释制剂,给药方式为皮下注射,可每1个月(7.5 mg)、3个月(22.5 mg)、4个月(30 mg)或6个月(45 mg)给药1次,以在给药间期维持体内亮丙瑞林水平、持续抑制睾酮。
3.3 Ecallantide(Kalbitor)
2009年另一个比较重要的批准药物是由Dyax公司开发的 Ecallantide(Kalbitor),是首个获得FDA批准用于治疗突发遗传性血管水肿的皮下制剂,也是这个14岁的大公司第一个被批准的新药。目前可用于治疗突发遗传性血管水肿的药物有两个,另一个是Cinryze(血源性C1-酯酶抑制剂,2008年获得FDA批准),在Cinryze获批之前没有任何治疗遗传性血管水肿的好方法,但仅仅一年以后,Kalbitor就以替代者的姿态问世。
3.4 ALN-AT3
2014年8月8日Alnylam制药宣布,欧洲药品管理局(EMA)孤儿药品委员会(COMP)已授予RNAi疗法ALN-AT3 孤儿药地位,用于A型血有病和B型血友病的治疗。目前,Alnylam正开发 ALN-AT3作为一种皮下注射RNAi疗法,靶向抗凝血酶(AT)病(包括A型血友病、有抑制剂的A或B型血友病)及其他罕 见出血性疾病(RBD)的治疗。FDA已于2013年8月授予 ALN-AT3治疗A型血友病和B型血友病 的孤儿药地位。ALN-AT3采用了 Alnylam制药专有的半乳糖胺共轭递送 平台(GalNAc-siRNA平台)开发,能够通过皮下注射给药。
3.5 Benlysta(belimumab,贝利木单抗)
2016年9月,英国制药公司葛兰素史克(GSK)宣布已向美国食品和药物管理局(FDA)和欧洲药品管理局(EMA)提交皮下注射剂型(SC)狼疮药物Benlysta(belimumab,贝利木单抗)治疗活动性、抗体阳性系统性红斑狼疮(SLE)的监管申请文件。
Benlysta通过静脉输注给药,每4周输注一次,耗时1个小时。皮下注射剂型Benlysta则通过皮下注射给药,产品有2种形式:单剂量预灌封注射器和单剂量自动注射器,将为SLE患者群体提供一种重要的个性化治疗选择。在美国和欧盟,皮下注射剂型Benlysta监管文件的提交,都是基于BLISS-SC III期关键性研究的数据,该研究在活动性自身抗体阳性SLE患者中开展,评估了每周一次皮下注射200mg belimumab联合标准疗法治疗的疗效和安全性。
3.6 Orencia(abatacept,阿巴西普)
2017年6月百时美施贵宝(BMS)宣布,推出一款新的皮下注射剂型(SC)Orencia(abatacept,阿巴西普)给药方案——预充式注射器,用于2岁及以上中度至重度活动性多关节型幼年特发性关节炎(JIA)患者的治疗。这款新的预充式注射器将为医生、患者及其照料者提供一种能够在家实施给药的Orencia治疗选择。在美国,静脉输注剂型(IV)Orencia于2008年获得美国食品和药物管理局(FDA)批准,成为用于6岁及以上中度至重度活动性多关节型JIA患者群体的首个IV生物制剂。
四、仍在开发品种
4.1 Halozyme Therapeutics公司同时与施贵宝及罗氏进一步合作。
2017年9月免疫肿瘤学巨头百时美施贵宝(BMS)宣布与Halozyme Therapeutics公司达成一项全球合作及许可协议,利用后者专有的ENHANZE药物递送技术,开发百时美施贵宝免疫肿瘤学药物的皮下注射剂型。
根据协议条款,Halozyme公司将获得一笔1.05亿美元的预付款。百时美施贵宝已选定多个免疫肿瘤学目标,包括程序性死亡受体1(PD-1),同时在协议生效之后的5年内拥有选择其他目标的权利。此次合作可扩展至最多11个目标。针对每个指定的合作目标,Halozyme将有资格获得高达1.6亿美元的里程碑款项,同时还有资格获得组合目标的额外里程碑款项。除此之外,百时美施贵宝还将支付Halozyme来自此次合作使用ENHANZE技术所开发产品在未来销售的特许权使用费。这也使得此次交易的潜在价值超过了18亿美元。
就在同一日,Halozyme公司宣布扩大与瑞士制药巨头罗氏(Roche)之间的合作。双方已达成了一项授权协议,将ENHANZE系统授权罗氏独家开发一种未公布的治疗靶标。根据协议,Halozyme将获得一笔3000万美元的预付款,同时将有资格获得高达1.6亿美元的里程碑款项,以及合作所诞生的任何产品在未来商业化销售的特许权使用费。事实上,双方早在2006年已经展开合作,目前罗氏已有2款皮下注射药物在全球范围内上市销售。Halozyme公司的ENHANZE技术基于一种专有的重组人透明质酸酶(rHuPH20),该酶能暂时性降解透明质酸(人体中存在的一种糖胺聚糖或天然糖链),帮助其他注射型治疗药物的分散和吸收。该技术可以更迅速地通过皮下注射途径递送大容量注射药物,例如目前通过静脉输注给药的治疗药物。在多个临床研究中,ENHANZE技术已被证明能够显著缩短药物给药时间。
4.2 先声药业
先声药业与美国Apexigen公司联合开发全球领先的抗VEGF人源化单克隆抗体药物;与国际著名生物制药企业百时美施贵宝公司共同研发抗肿瘤药物;双方携手开发用于治疗类风湿性关节炎的皮下注射生物药物阿巴西普针剂,目前已进入临床研究阶段。
4.3 思路迪与康宁杰瑞联合开发的PD-L1 KN035
2016年11月29日,思路迪宣布公司与康宁杰瑞联合开发的的新一代的PD-L1抗体KN035已经通过美国食品药品监督管理局(FDA)的审评,获准在美国开展临床研究。目前该项目在中国、美国、日本同步开展临床研究。
KN035与目前已经上市和在研的PD1/PDL1抗体有明显差异化。KN035是目前全球唯一进入临床开发针对肿瘤免疫治疗的单域抗体,具有可皮下注射,常温下稳定等优点,可大大提高用药依从性,改善肿瘤病人生活品质,为实现将肿瘤作为慢性病长期管理的目标有非常重要的价值。
最后,再来说一下皮下注射的优势和应用:皮下制剂是一种常用的改进给药方式、提高药物吸收和患者依从性的方法。目前生物药如单克隆抗体在临床上通常需要大剂量使用,尤其是在慢性疾病的治疗方面,该类药物大多需通过静脉注射,不可避免会发生与注射相关的副作用,造成这些药物的价格往往非常昂贵,在慢性疾病中产生大量的医疗费用及不便捷性。
 下载格隆汇APP
下载格隆汇APP
 下载诊股宝App
下载诊股宝App
 下载汇路演APP
下载汇路演APP

 社区
社区
 会员
会员



